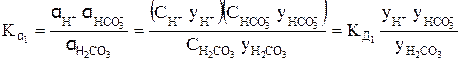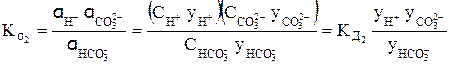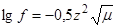Коэффициент активности тем больше чем больше
Активность и коэффициент активности
Несмотря на то, что термодинамика не учитывает процессы, происходящие в реальных растворах, например, притяжение и отталкивание ионов, термодинамические закономерности, выведенные для идеальных растворов, можно применить и для реальных растворов, если заменить концентрации активностями.
Активность может быть как меньше, так и больше номинальной концентрации вещества в растворе. Активность чистого растворителя, а также растворителя в не слишком концентрированных растворах принимается равной 1. За 1 принимается также активность твёрдого вещества, находящегося в осадке, или жидкости, не смешивающейся с данным раствором. В бесконечно разбавленном растворе активность растворённого вещества совпадает с его концентрацией.
Отношение активности вещества в данном растворе к его концентрации называется коэффициентом активности.
Отклонения от идеальности в растворах сильных электролитов
Особенно заметное отклонение от идеальности имеет место в растворах сильных электролитов. Это отражается, например, на их температурах кипения, плавления, давлении пара над раствором и, что особенно важно для аналитической химии, на величинах констант различных равновесий, протекающих в таких растворах.
Для характеристики активности электролитов используют:
Величина, которая учитывает влияние концентрации (С) и заряда (z) всех ионов, присутствующих в растворе, на активность растворённого вещества, называется ионной силой (I).
Пример 3.1. В 1,00 л водного раствора содержится 10,3 г NaBr, 14,2 г Na2SO4 и 1,7 г NH3. Чему равна ионная сила такого раствора?


I = 0,5×[0,300×(+1) 2 + 0,100×(-1) 2 + 0,100×(-2) 2 ] = 0,400 моль/л
Рис. 3.1. Влияние ионной силы на среднеионный коэффициент активности HCl
На рис. 3.1 показан пример влияния ионной силы на активность электролита (HCl). Аналогичная зависимость коэффициента активности от ионной силы наблюдается также у HClO4, LiCl, AlCl3 и многих других соединений. У некоторых электролитов (NH4NO3, AgNO3) зависимость коэффициента активности от ионной силы является монотонно убывающей.
Универсального уравнения, с помощью которого можно было бы рассчитать коэффициент активности любого электролита при любой величине ионной силы, не существует. Для описания зависимости коэффициента активности от ионной силы в очень разбавленных растворах (до I
При более высоких значениях ионной силы (до
1) количественную оценку коэффициента активности можно проводить по уравнению Дэвиса.
В данном уравнении a принято равным 3,05, поэтому произведение Ba равно 1. Фактор 0,2I учитывает образование ионных пар, изменение диэлектрической проницаемости и т.д.
Пример 3.2. Рассчитать коэффициенты активности иона H + при ионной силе 0,010 и 0,10.


3.4. Виды констант химического равновесия, используемые в аналитической химии
Дополнения. 1. Активность. Коэффициент активности



1. Активность. Коэффициент активности.
Ионная сила раствора. Термодинамическая константа диссоциации
В водных растворах электролитов наличие зарядов у ионов электростатически тормозит передвижение их. Поэтому концентрация растворённого вещества без учёта сил взаимодействия между ионами и молекулами в растворе не может полностью характеризовать свойства его. Чем выше концентрация раствора, содержащего многозарядные ионы, тем значительнее в нём силы взаимодействия между ионами и тем больше отклонения от закона действующих масс.
Способность ионов к химическим реакциям, вызываемая их электростатическим взаимодействием, характеризуется активностью.
Активность ионов связана с концентрацией вещества в растворе уравнением
где α – активность ионов выражает эффективную концентрацию электролита в растворе (иначе «термодинамическую концентрацию»), имеет ту же единицу измерения, что и концентрация; g – моляльный коэффициент активности учитывает все те силы, которые действуют в растворе, и в первую очередь, силы электростатического взаимодействия между ионами. Коэффициент активности безразмерная величина. Он характеризует работу перенесения одного моля растворенного вещества из идеального в реальный раствор при Р, Т = const; Cm – моляльность вещества В в растворе, моль/1000 г Н2О или моль/кг Н2О.
В том случае, если раствор имеет молярную концентрацию вещества В, то уравнение (1) примет вид
где у – молярный коэффициент активности; С – молярная концентрация вещества В, моль/л.
Активность вещества АmВn, диссоциирующего в водном растворе по уравнению
равна 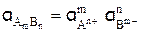
Для разбавленных растворов слабых электролитов коэффициент активности у = 1 и α = С. Поэтому слабые электролиты подчиняются с достаточной точностью закону действующих масс, и при проведении расчётов в формулу закона действующих масс можно подставлять концентрации ионов.
Для концентрированных растворов слабых кислот следует пользоваться значениями активности ионов, а не концентрациями.
Так, для концентрированного раствора слабой угольной кислоты, в отличие от разбавленного раствора, выражения для константы диссоциации этой кислоты по первой и второй ступеням в растворах, имеющих молярную концентрацию, будет иметь вид:
H2CO3 « H + + 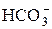
или 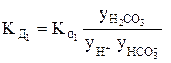
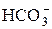
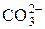
или 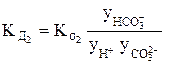
В выражениях (4) и (5) 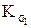
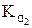
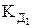
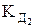
Согласно уравнениям (4) и (5) при уменьшении концентрации ионов в растворе кислоты у ® 1, а Кα приближается к Кд.
Для сильных электролитов g » у » l только в очень разбавленных растворах
(С –4 моль/л) и α » С. При С > 10 –4 моль/л коэффициент активности, как правило, меньше единицы. Это значит, что ион стеснён в своих движениях межионными силами, и α
Вычисления величин коэффициентов активности очень сложны. Но для разбавленных растворов коэффициент активности может быть рассчитан по формулам:
lgg = –0,5 Zк Zа 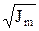
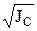
где g и у – средний моляльный и молярный коэффициенты активности;
Zк и Zа – заряд катиона и аниона; Jm и Jc – ионные силы раствора для моляльной и молярной концентраций соответственно.
Ионная сила раствора является мерой напряжённости электрического поля, существующего в растворе, и равна полусумме произведении концентраций всех ионов, присутствующих в растворе на квадрат их заряда:
Jm = 0,5 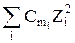
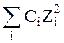
где Cm и С – моляльная и молярная концентрации соответственно; Zi – заряд иона.
Ионная сила Jm имеет единицу моль/1000 г Н2О или моль/кг Н2О, Jc – моль/л.
В разбавленных растворах электролитов с одинаковой ионной силой коэффициенты активности большинства ионов, имеющих один и тот же заряд, приблизительно одинаковы (см. табл. 1).
Пример 1. Найдите коэффициенты активности ионов Fe 3+ и 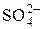
Пользуясь табл. 1, находим, что при Jc = 0,0001 (10 –4 ) моль/л, коэффициент активности иона Fe 3+ равен 0,9, а иона 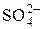
Приближённые значения средних коэффициентов активности
ионов в зависимости от ионной силы раствора
| Ионная сила JС, моль/л | Коэффициент активности у | |||
| Однозарядные ионы | Двухзарядные ионы | Трёхзарядные ионы | Четырёхзарядные ионы | |
| 1×10 –4 | 0,99 | 0,95 | 0,90 | 0,83 |
| 1×10 –3 | 0,96 | 0,86 | 0,73 | 0,56 |
| 1×10 –2 | 0,89 | 0,63 | 0,39 | 0,19 |
| 1×10 –1 | 0,78 | 0,33 | 0,08 | 0,01 |
Пример 2. Найдите активность ионов Na + и Сl – в 0,001 М растворе NaCl. Ионная сила 0,001 М раствора NaCl (см. уравнение 7) равна
Jc = 0,5( 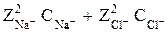
Средний коэффициент активности у при ионной силе раствора 10 –3 моль/л для однозарядных ионов равен 0,96 (см. табл. 11). Следовательно, активность ионов
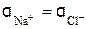
Пример 3. Найдите активность 0,005 М раствора Al2(SО4)3, если 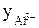
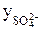
Активность раствора Al2(SО4)3 (см, уравнение 3) равна
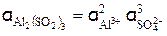
Пример 4. Найдите ионную силу раствора, содержащего 0,04 моль Рb(NO3)2 и 0,02 моль К2SO4 в 2 л раствора.
Находим содержание количества вещества (моль) Рb(NO3)2 и К2SO4 в 1 л раствора. Это будет 0,02 моль Рb(NO3)2 и 0,01 моль К2SO4. Ионная сила раствора (см. уравнение 7)
Jc = 0,5( 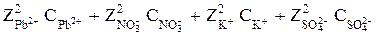
= 0,5(2 2 ×0,02 + 1 2 ×0,02 + 1 2 ×0,01 + 2 2 ×0,01) = 0,09 моль/л.
Активность и ионная сила электролита.
В настоящее время все термодинамические расчеты свойств растворов сильных электролитов строятся на использовании введенной Льюисом величины активности электролитаили активности его ионов.Активность определяется как величина, подстановка которой вместо концентрации в термодинамические уравнения делает их применимыми к рассматриваемым растворам.
Активности отличаются от концентраций только тем, что в них входят силы взаимодействия, существующие в растворах и не зависящие от природы растворенных частиц, а также от их концентрации. Поэтому активность можно представить как произведение концентрации на некоторый переменный фактор, называемый коэффициентом активности: a=fC.
где а — активность электролита (или его ионов), С — аналитическая концентрация электролита, f— коэффициент активности, включающий поправку на силы взаимодействия.
Коэффициенты активности можно найти, сравнивая аналитические, концентрации с теми величинами, которые следует подставить в уравнение для растворов электролитов, чтобы получить полное соответствие с опытными данными. Обычно их определяют экспериментальным путем по величине осмотического давления, по понижению температуры замерзания, по повышению температурь: кипения раствора или же путем измерения эдс, соответствующей гальванической цепи.
Коэффициент активности, как правило, бывает меньше единицы, лишь при очень большом разбавлении раствора, когда силы взаимодействия между ионами приближаются к нулю, коэффициент активности становится равным единице. В этом случае а »С, т. е. движение ионов в растворе не стеснено. У сильных электролитов, например, что имеет место только в очень разбавленных растворах при С
Для разбавленных растворов, ионная сила которых не превышает 0,01, коэффициент активности ионов связан с ионной силой раствора следующим соотношением:
Из этой формулы следует, что чем больше ионная сила раствора, тем меньше коэффициент активности его ионов; если ионные силы двух растворов равны, то коэффициенты активности равновалентных ионов также одинаковы.
Поэтому при теоретических расчетах химических реакций в растворах в связи, например, с использованием закона действующих масс, необходимо брать не концентрации веществ, находящихся в растворе, а действующие активные массы исходных реагентов и образующихся продуктов реакции, которые в данный момент непосредственно участвуют в химическом процессе.
Дата добавления: 2015-05-13 ; просмотров: 3367 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Коэффициенты активности
Что такое Коэффициенты активности?
Ключевые моменты
Понимание коэффициентов активности
Коэффициенты активности наиболее полезны, когда используются для сравнения двух конкурирующих предприятий в одной отрасли, чтобы определить, как конкретная компания выделяется среди своих аналогов. Но коэффициенты активности также можно использовать для отслеживания финансового прогресса компании за несколько периодов регистрации, чтобы обнаруживать изменения с течением времени. Эти цифры могут быть нанесены на карту, чтобы представить перспективную картину перспективных результатов деятельности компании.
Коэффициенты активности можно разбить на следующие подкатегории:
Коэффициент оборачиваемости дебиторской задолженности
Коэффициент оборачиваемости дебиторской задолженности определяет способность организации получать деньги от своих клиентов. Общая сумма продаж в кредит делится на средний остаток дебиторской задолженности за определенный период. Низкое соотношение указывает на недостаток в процессе сбора.
Коэффициент оборачиваемости товарных запасов
Общий коэффициент оборачиваемости активов
Коэффициент оборачиваемости общих активов показывает, насколько эффективно предприятие использует свои активы для продажи. Общие продажи делятся на общие активы, чтобы определить, насколько эффективно бизнес использует свои активы. Меньшие коэффициенты могут указывать на то, что компания изо всех сил пытается продвигать свою продукцию.
Рентабельность капитала
Показатель эффективности, известный как рентабельность капитала (ROE), измеряет доходы, полученные от акционерного капитала. ROE рассчитывается путем деления чистой прибыли на все акции, находящиеся в обращении на рынке.
Коэффициент оборачиваемости активов
Показатель, называемый коэффициентом оборачиваемости активов, измеряет сумму дохода, которую компания генерирует на доллар активов. Этот показатель, который просто рассчитывается путем деления продаж компании на ее общие активы, показывает, насколько эффективно компания использует свои активы для увеличения продаж.
Коэффициенты активности по сравнению сПоказатели прибыльности
Коэффициенты активности и коэффициенты прибыльности являются фундаментальными аналитическими инструментами, которые помогают инвесторам оценивать различные аспекты финансовой устойчивости компании. Коэффициенты прибыльности отражают получение компанией прибыли, а коэффициенты эффективности измеряют, насколько хорошо компания использует свои ресурсы для получения этой прибыли. Коэффициенты прибыльности могут помочь аналитикам сравнить прибыль компании с прибылью ее отраслевых конкурентов, а также отслеживать прогресс той же компании за несколько различных отчетных периодов.
Определение коэффициентов активности
Опубликовано 05.07.2021 · Обновлено 05.07.2021
Что такое коэффициент активности?
Коэффициент активности – это тип финансового показателя, который показывает, насколько эффективно компания использует активы на своем балансе для получения доходов и денежных средств. Обычно называемые коэффициентами эффективности, коэффициенты активности помогают аналитикам оценить, как компания осуществляет управление запасами, что является ключом к ее операционной текучести и общему финансовому состоянию.
Ключевые выводы
Понимание коэффициентов активности
Коэффициенты активности наиболее полезны, когда используются для сравнения двух конкурирующих предприятий в одной отрасли, чтобы определить, как конкретная компания выделяется среди своих аналогов. Но коэффициенты активности также могут использоваться для отслеживания финансового прогресса компании за несколько периодов регистрации, чтобы обнаруживать изменения с течением времени. Эти цифры могут быть нанесены на карту, чтобы представить перспективную картину перспективных результатов деятельности компании.
Коэффициенты активности можно разбить на следующие подкатегории:
Коэффициент оборачиваемости дебиторской задолженности
Коэффициент оборачиваемости дебиторской задолженности определяет способность организации получать деньги от своих клиентов. Общая сумма продаж в кредит делится на средний остаток дебиторской задолженности за определенный период. Низкое соотношение указывает на недостатки в процессе сбора.
Коэффициент оборачиваемости товарных запасов
Коэффициент оборачиваемости товарных запасов измеряет, как часто остаток товарных запасов продается в течение отчетного периода. Себестоимость проданных товаров делится на средний инвентаризации в течение определенного периода. Более высокие расчеты показывают, что компания может относительно легко перемещать свои запасы.
Общий коэффициент оборачиваемости активов
Коэффициент оборачиваемости общих активов показывает, насколько эффективно предприятие использует свои активы для продажи. Общие продажи делятся на общие активы, чтобы определить, насколько эффективно бизнес использует свои активы. Меньшие коэффициенты могут указывать на то, что компания изо всех сил пытается продвигать свою продукцию.
Рентабельность капитала
Показатель производительности, известный как рентабельность собственного капитала (ROE), измеряет доходы, полученные от акционерного капитала. ROE рассчитывается путем деления чистой прибыли на все акции, находящиеся в обращении на рынке.
Коэффициент оборачиваемости активов
Показатель, называемый коэффициентом оборачиваемости активов, измеряет сумму дохода, которую компания генерирует на доллар активов. Этот показатель, который просто рассчитывается путем деления продаж компании на ее общие активы, показывает, насколько эффективно компания использует свои активы для увеличения продаж.
Коэффициенты активности по сравнению сПоказатели рентабельности
Коэффициенты активности и коэффициенты прибыльности являются фундаментальными аналитическими инструментами, которые помогают инвесторам оценивать различные аспекты финансовой устойчивости компании. Коэффициенты прибыльности отражают получение компанией прибыли, а коэффициенты эффективности измеряют, насколько хорошо компания использует свои ресурсы для получения этой прибыли. Коэффициенты прибыльности могут помочь аналитикам сравнить прибыль компании с прибылью ее отраслевых конкурентов, а также отслеживать прогресс одной и той же компании за несколько разных отчетных периодов.