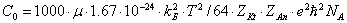Коэффициент активности тем меньше чем
Активность и коэффициент активности
Несмотря на то, что термодинамика не учитывает процессы, происходящие в реальных растворах, например, притяжение и отталкивание ионов, термодинамические закономерности, выведенные для идеальных растворов, можно применить и для реальных растворов, если заменить концентрации активностями.
Активность может быть как меньше, так и больше номинальной концентрации вещества в растворе. Активность чистого растворителя, а также растворителя в не слишком концентрированных растворах принимается равной 1. За 1 принимается также активность твёрдого вещества, находящегося в осадке, или жидкости, не смешивающейся с данным раствором. В бесконечно разбавленном растворе активность растворённого вещества совпадает с его концентрацией.
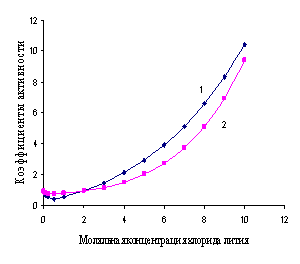
Отношение активности вещества в данном растворе к его концентрации называется коэффициентом активности.
Отклонения от идеальности в растворах сильных электролитов
Особенно заметное отклонение от идеальности имеет место в растворах сильных электролитов. Это отражается, например, на их температурах кипения, плавления, давлении пара над раствором и, что особенно важно для аналитической химии, на величинах констант различных равновесий, протекающих в таких растворах.
Для характеристики активности электролитов используют:
Величина, которая учитывает влияние концентрации (С) и заряда (z) всех ионов, присутствующих в растворе, на активность растворённого вещества, называется ионной силой (I).
Пример 3.1. В 1,00 л водного раствора содержится 10,3 г NaBr, 14,2 г Na2SO4 и 1,7 г NH3. Чему равна ионная сила такого раствора?


I = 0,5×[0,300×(+1) 2 + 0,100×(-1) 2 + 0,100×(-2) 2 ] = 0,400 моль/л
Рис. 3.1. Влияние ионной силы на среднеионный коэффициент активности HCl
На рис. 3.1 показан пример влияния ионной силы на активность электролита (HCl). Аналогичная зависимость коэффициента активности от ионной силы наблюдается также у HClO4, LiCl, AlCl3 и многих других соединений. У некоторых электролитов (NH4NO3, AgNO3) зависимость коэффициента активности от ионной силы является монотонно убывающей.
Универсального уравнения, с помощью которого можно было бы рассчитать коэффициент активности любого электролита при любой величине ионной силы, не существует. Для описания зависимости коэффициента активности от ионной силы в очень разбавленных растворах (до I
При более высоких значениях ионной силы (до
1) количественную оценку коэффициента активности можно проводить по уравнению Дэвиса.
В данном уравнении a принято равным 3,05, поэтому произведение Ba равно 1. Фактор 0,2I учитывает образование ионных пар, изменение диэлектрической проницаемости и т.д.
Пример 3.2. Рассчитать коэффициенты активности иона H + при ионной силе 0,010 и 0,10.


3.4. Виды констант химического равновесия, используемые в аналитической химии
Активность и коэффициентов активности компонента
Активность компонентов раствора — эффективная (кажущаяся) концентрация компонентов с учётом различных взаимодействий между ними в растворе, то есть с учётом отклонения поведения системы от модели идеального раствора.
Активность отличается от общей концентрации на некоторую величину. Отношение активности ( 
64. Выбор стандартных состояний
При использовании активности и коэффициента активности важную роль играет выбор стандартного состояния компонента, то есть состояния, в котором
Для растворов взаимно неограниченно растворимых жидкостей в качестве стандартного может быть выбрано состояние чистого компонента:
при 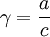

Иногда такой выбор называют симметричной системой стандартного состояния.
В случае, если рассматривается раствор газа и или твердого вещества в жидкости, мольную долю растворенного вещества нельзя изменять до единицы. Тогда для растворителя — жидкости — стандартное состояние может быть выбрано так же, как показано выше, а для растворенного вещества за стандартное состояние принимают гипотетический раствор с концентрацией, равной единице, но сохраняющий свойства предельно разбавленного раствора. Иначе говоря, это такое состояние, для которого давление пара численно равно константе Генри:

Таким образом, для растворителя и растворенного вещества здесь принимаются разные стандартные состояния — это несимметричная система стандартных состояний.
В системах с ограниченной растворимостью за стандартное может быть принято состояние компонента в насыщенном растворе:
В засимости от исследуемой системы, в качестве стандартного может быть выбрано и другое состояние, например, для серы при исследовании богатых сульфидных расплавов — состояние серы в стехиометрическом сульфиде. При рассмотрении результатов эксперимента, использовании справочных данных и т. п. следует обязательно указывать, какое именно состояние компонента принято за стандартное.
Численное значение активности и коэффициентов термодинамической активности зависит от способа выбора стандартного состояния. Стандартное состояние может быть выбрано произвольно, но оно должно быть таким, чтобы полученными в последствии активностью и термодинамическим коэффициентом активности было удобно пользоваться.
Существует два основных способа выбора стандартного состояния:
1.В симметричном способе за стандартное состояние любого компонента выбирают состояние чистого (индивидуального) компонента при температуре системы (раствора). Тогда в стандартном состоянии имеем:



Способ чаще используют в термодинамике растворов неэлектролитов.
2.В соответствии сассиметричным (не симметричным) способом стандартное состояние различно выбирают для различных компонентов системы.
Для растворителя стандартное состояние выбирают так же, как и в симметричном способе, т.е.: 


Для растворенного вещества за стандартное состояние выбирают состояние данного вещества в бесконечно разбавленном растворе, т.е.:


Этот способ используется в термодинамике растворов электролитов
65. Методы определения коэффициентов активности
Экспериментальные методы определения активности компонентов в растворе основаны на изучении какого-либо гетерогенного равновесия в системе. При рассмотрении этих методов следует помнить, что в условиях равновесия химические потенциалы i-го компонента в разных фазах (I и II) равны:

Это соотношение является исходной точкой для вывода расчетных уравнений в некоторых из методов определения активности. Кроме того, активности компонентов в некоторой фазе связаны между собой уравнением:

По равновесному давлению пара
В основе этого метода лежит соотношение:

где 


Экспериментальные методы определения давления пара компонентов над раствором весьма разнообразны; выбор того или иного из них определяется, в частности, исследуемой системой (водный раствор или иная низкотемпературная система, либо расплавленный металл, шлак, штейн и т. п.).
По повышению температуры кипения раствора
Температура кипения раствора 


где 
По понижению температуры замерзания раствора
Температура замерзания раствора 


где 
По осмотическому давлению раствора
Величина осмотического давления раствора может быть использована для определения активности растворителя в соответствии с соотношением:

где 

По распределению компонента между конденсированными фазами
Активность компонента раствора можно определить, изучая равновесное распределение его между двумя контактирующими конденсированными фазами (различными растворителями, сплавом и шлаком, шлаком и штейном и т. п.), одна из которых — исследуемый раствор, а для другой активность или коэффициент активности уже известны. В общем случае:

В частности, если выбор стандартного состояния компонента для фаз таков, что 

Экспериментально в этом методе определяют равновесные концентрации компонента или коэффициент распределения компонента между растворами.
По равновесию химической реакции с газовой фазой
При исследовании оксидных расплавов активность компонентов часто определяют, используя следующие химические реакции:
MeO + H2 = Me + H2O
MeO + CO = Me + CO2
Для первой из приведенных реакций константа равновесия имеет вид: 
Если оксидный и металлический расплавы взаимно нерастворимы и восстанавливается индивидуальный оксид, то 

Если металл выделяется в виде сплава с другими компонентами или растворяется в фазе-коллекторе, его активность не равна единице и формула принимает вид: 
Активность металла в сплаве здесь должна быть известна из независимых измерений.
Опытным путем в данном методе определяют отношение 
Кроме того, активность оксидного компонента связана с равновесным давлением кислорода над расплавом, с учётом реакций в газовой фазе, например: 
или 
Тогда можно показать, что
Для сульфидных расплавов используют реакцию:

или (значительно реже):

По значению э. д. с. гальванического элемента
Электродвижущая сила концентрационной цепи с переносом может быть выражена следующим соотношением:
66. Коллигативные свойства растворов, их термодинамическое обоснование, практическое использование для определения молекулярной массы растворённого вещества.
Свойства растворов, которые зависят только от концентрации частиц в растворе и не зависят от природы растворенного вещества, называются коллигативными.
Растворы, образованные частицами строго одинакового размера, между которыми действуют примерно одинаковые силы межмолекулярного взаимодействия, не происходит химического взаимодействия, изменения температуры и объема называются идеальными. К идеальным растворам стремятся очень разбавленные растворы.
Коллигативные свойства разбавленных растворов могут быть описаны количественно и выражены в виде законов. К ним относятся:
· давление насыщенного пара растворителя над раствором
· температура кристаллизации раствора
· температура кипения раствора
Дата добавления: 2015-01-29 ; просмотров: 55 ; Нарушение авторских прав
Научная электронная библиотека
1.3.4. Коэффициенты активности
Электростатические взаимодействия приводят к значительным отклонениям в поведении системы от идеального. Учесть отклонения от идеального, т.е. предусмотреть влияние электростатических факторов можно с помощью метода активностей: вместо концентраций реагирующих частиц [A] используют величины, называемые активностями aA. Численные значения активностей выбирают таким образом, чтобы форма функциональной зависимости для свободной энергии
сохранялась и для реальных растворов:
Тогда для общей реакции
Отношение активности частицы к ее равновесной концентрации
называется коэффициентом активности. Коэффициенты активности ионов в растворах электролитов могут служить мерой электростатических взаимодействий в системе. Для идеальных растворов электростатические взаимодействия пренебрежимо малы, активности приравниваются равновесным концентрациям, тогда g = 1.
Известно несколько методов определения и расчета коэффициентов активности. Поскольку электростатические взаимодействия весьма заметны в растворах электролитов, то остановимся на расчетах коэффициентов активности ионов. Они зависят от ионной силы, вычисляемой по известному уравнению:
Одним из наиболее применяемых методов определения коэффициентов активности индивидуальных ионов является оценка по приближению Дебая-Хюккеля [8]
В разбавленных растворах (I 2 (I) 1/2 /[1+aB(I) 1/2 ]+ CI,
Экспериментально определить коэффициенты активности отдельных ионов невозможно, так как нельзя получить раствор, содержащий ионы только одного сорта. Опытным путем можно было измерить лишь средний коэффициент активности g± ионов электролита AmBn, который связан с коэффициентами активности составляющих его ионов A n+ и B m- следующим образом:
Уравнения Дебая-Хюккеля и Дэвиса пригодны в первом приближении и для расчетов коэффициентов активности незаряженных молекул (неэлектролитов). В этих случаях zi = 0 и в уравнениях Дебая-Хюккеля коэффициент активности неэлектролита равен единице при ионной силе I £ 0.1 М, при больших значениях ионной силы необходимо использовать уравнение Дэвиса, которое для неэлектролитов превращается в lgg = CI. Константа С в этом случае называется солевым коэффициентом, зависящим от диэлектрической проницаемости неэлектролита e. Для веществ с низкойe (газы, сахара, белки) C>0, g > 1. Для таких веществ наблюдается эффект “высаливания”, т.е. уменьшение их растворимости в воде в присутствии электролитов. Для веществ же с высокой e(например, для HCN e = 111) C 2 ћ 2 CiNA/m·1000· kБ 2 T 2 ) 1/2 ] (1.23)
В данной работе предложено модельное уравнение расчета оптимальных концентраций электролитов, соответствующих минимуму коэффициента активности и рассуждения 17.
Показано, что в точке минимума функции
а затем − к выражению (4):
Уравнения (1.23) и (1.24) выражают коэффициент активности для неассоциированных ионов электролита, тогда как литературные (экспериментальные) величины g± учитывают в этой точке фактические (реальные) взаимодействия сольватированных ионов с образованием молекулярной формы электролита или ионных ассоциатов по равновесию (а). Поэтому не следует ожидать полного тождества коэффициентов активности, теоретически оцененных по уравнению (1.24), с литературными, но, безусловно, важен характер зависимости коэффициентов активности от концентраций.
В табл.1.3 приведены полученные концентрации для 42 электролитов при gmin.
Что касается увеличения коэффициента активности g при больших концентрациях электролита, то не было предложено рациональной количественной теории, определяющей концентрации растворов с минимумом g и значительным увеличением его с повышением моляльности. В данной работе дается объяснение этому факту и рассчитаны оптимальные концентрации электролитов, соответствующие минимуму коэффициента активности. Так, за пределами концентрации С0, соответствующей минимуму коэффициента активности, в связи с сокращением длин свободного пробега сольватированных ионов или молекул, превалирующими становятся межионные взаимодействия, приводящие преимущественно к ионным ассоциатам в полярных с низкими значениями диэлектрических проницаемостей растворителях или к молекулярным сольватам в неполярных с низкими значениями диэлектрических проницаемостей растворителях.
Уравнение (1.24) позволяет рассчитывать теоретические значения коэффициентов активности различных электролитов в зависимости от их концентраций. Функция проходит через минимум при С0, повторяя контур зависимости фактических (реальных) g± от моляльности растворов (рис. 1.1 и 1.2).
Рис. 1.1. Зависимости рассчитанных (1) и экспериментальных (2) коэффициентов активности от моляльной концентрации водного раствора хлороводородной кислоты
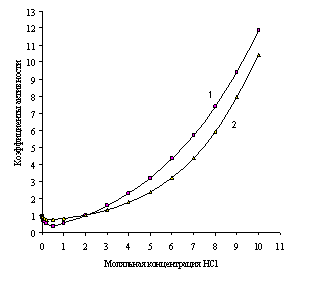
Рис. 1.2. Зависимости рассчитанных (1) и экспериментальных (2) коэффициентов активности от моляльной концентрации водного раствора хлорида лития
На рис. 1.1 и 1.2 показана приемлемость предлагаемой модельной оценки коэффициента активности в связи с достаточно заметным соответствием хода зависимости функций g = f (m) и g± = f (m) для водных растворов хлороводородной кислоты (рис. 1.1) и хлорида лития (рис. 1.2).
В табл. 1.4 в качестве примера представлены экспериментальные (литературные) и рассчитанные по уравнению (1.24) величины коэффициентов активности хлороводородной кислоты и хлорида лития.
Таким образом, в данной работе теоретически обосновываются области концентраций растворов электролитов, в которых наблюдается минимум коэффициентов активности, объясняется феномен доминирования ассоциативных явлений, приводящих к образованию ионных ассоциатов или в зависимости от свойств и природы растворителя − к преимущественному состоянию растворов в виде молекулярных сольватов.
Коэффициенты активности HCl и LiCl, оцененные по уравнению (1.24), в сравнении с экспериментальными в зависимости от концентрации С (моль/1000 г)