Конгломерат лимфоузлов что это
Увеличенные лимфоузлы. Вам к онкологу или к терапевту?
Каждое третье обращение к онкологу в социальных сетях или на порталах удаленного консультирования формулируется примерно так: «спасите-помогите, у меня увеличенные лимфоузлы».
Как правило, пишут молодые люди, обычно от 18 до 25 лет, и я не помню случая, когда в итоге выяснялось, что ситуация требует лечения у онколога. Чаще всего увеличение лимфоузлов вызывали больной зуб, горло, конъюнктивит и так далее.
Понятно, что страх и опасения за свое здоровье в таких случаях заставляют сразу же бежать к онкологу.
Однако так ли все просто, и стоит ли закатывать глаза по поводу любого обращения с увеличенным л/узлом?
Моя личная статистика показывает: если человек пришел на очную консультацию, он уже один из тех немногих, у кого ситуация не ограничилась банальным «поболело и прошло».
Разберем подробнее, как устроена лимфатическая система и поймем природу увеличенных лимфоузлов.
Факт №1
Лимфатические узлы — неотъемлемая часть нашего организма.
Всего их порядка нескольких сотен и располагаются они обычно вдоль лимфатических сосудов, которые обычно проходят вдоль крупных венозных сосудов.
Лимфатические сосуды дренируют лимфу (межтканевая жидкость) и «фильтруют» ее через лимфатические узлы, где армия лимфоцитов готова расправиться почти с любой заразой.
Факт №2
Лимфатические сосуды — это не что-то абстрактное.
Стоит пересечь или перевязать их, например, при операции на подмышечных лимфатических узлах по поводу рака молочной железы, и с большой вероятностью разовьется лимфостаз — отек конечности, который, опять-таки, с большой вероятностью не пройдет.
Наиболее видимые для нас с точки зрения осмотра — так называемые периферические лимфатические узлы (на шее, надключичные, подмышечные и паховые) могут увеличиваться, и это в большинстве случаев проявления реактивной лимфаденопатии — воспалительной реакции, свидетельствующей о борьбе с инфекцией.
Факт №3
Чаще всего воспаляются шейные и подчелюстные л/узлы, потому что в лицевом отделе черепа множество открытых слизистых и связанных с ними инфекций.
Воспаленное горло, кариозные или гнилые зубы, ушные и глазные бактериальные и вирусные инфекции — наиболее частые причины шейной лимфаденопатии. По тому же принципу реагируют подмышечные и паховые л/узлы.
Поэтому, если беспокоит лимфатический узел, в первую очередь нужно пойти к терапевту, стоматологу, ЛОР-врачу.
При непонятном генезе лимфаденопатии врач назначит УЗИ, и в процессе этого исследования внимание будет направлено в основном не на размер л/узла, а на его форму и дифференцировку структуры.
Факт №4
Понять природу увеличения лимфатических узлов по вотсапу или во время телемедицинской консультации невозможно.
Увеличение лимфатического узла даже до 1,5-2 см в отсутствие нарушения дифференцировки.
Факт №5
Лимфатические узлы увеличиваются при онкологических заболеваниях, потому что в лимфатические сосуды, дренирующие определенную зону, попадают раковые клетки, которые потом оседают в «фильтрах» (лимфатических узлах) в виде метастазов и начинают там расти.
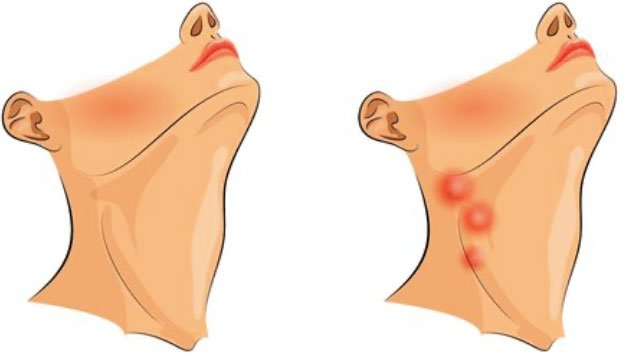
Такие лимфатические узлы не уменьшаются после лечения инфекционных заболеваний, а только увеличиваются, сливаясь с другими лимфатическими узлами в конгломераты, выходят за пределы л/узла и фиксируют его в окружающих тканях. Такие лимфатические узлы редко болезненны, они плотные, очень плотные.
Часто при онкологических заболеваниях лимфоузлы поражаются «цепочкой», хорошо определяемой при пальпации. При лимфомах конгломераты часто видны со стороны. Конечно, с такими проявлениями надо идти к онкологу и гематологу.
При подозрительных узлах в отсутствие других причин будет выполнена биопсия. Это либо прокол иглой с забором материала, либо операция по полному удалению лимфатического узла для проведения гистологического исследования.
Подведем итоги
Большинство случаев увеличения лимфатических узлов связано с воспалительными процессами. УЗИ позволяет оценить структуру лимфатического узла и помогает доктору решить вопрос о необходимости биопсии.
И самое главное — прежде чем отправиться с увеличенным лимфатическим узлом к врачу-онкологу, необходимо обратиться хотя бы к терапевту, который проведет осмотр и попытается исключить банальные вещи.
Не болейте!
Почитать Instagram Руслана Абсалямова можно здесь.
Метастатическое поражение шейных лимфатических узлов
Шейные лимфатические узлы являются частым местом метастазирования злокачественных опухолей, первичный очаг которых располагается в области головы и шеи. К ним, например, относятся плоскоклеточный рак верхних отделов дыхательных путей, а также метастазы рака слюнных желез и щитовидной железы.
Наиболее распространенным клиническим признаком является увеличивающееся образование шеи, которое обычно обнаруживается пациентом или его врачом. При подозрении на метастатическое поражения лимфатических узлов шеи для диагностики и определения наилучшей тактики лечения потребуется осмотр врачом-онкологом, инструментальные методы и биопсия.
Иногда новообразования вне области головы и шеи могут неожиданно метастазировать в шейные лимфатические узлы, что требует особенно тщательной диагностики для выявления первичного очага.
Лечение будет зависеть от типа и локализации первичной опухоли, которая распространилась в лимфатические узлы шеи, и, скорее всего, будет включать в себя комбинацию хирургического вмешательства, лучевой терапии и/или химиотерапии.
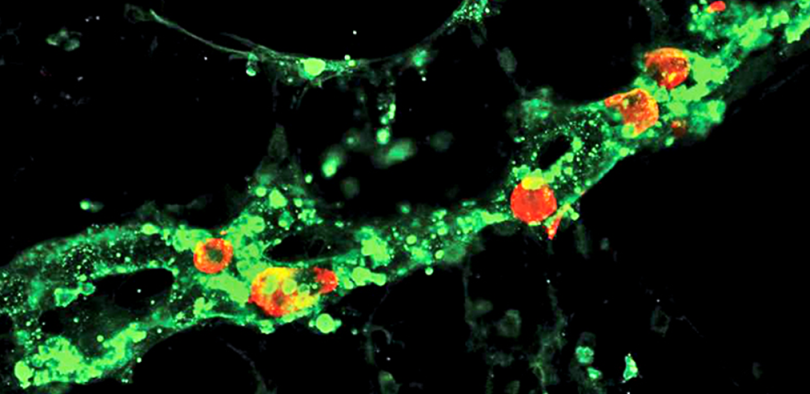
Иммунофлюоресцентная визуализация метастатических клеток меланомы (красные) внутри лимфатических сосудов (зеленые). Масштабная линейка: 100 мкм
(Science Advances/Michael Detmar Group ©)
Из чего состоит лимфатическая система шеи
Лимфатическая система шеи включает в себя сосуды и узлы.
Лимфатические капилляры — это тонкостенные структуры, состоящие из одного слоя эндотелиальных клеток. Они находятся во всех тканях организма и, объединяясь друг с другом, способствуют оттоку лимфатической жидкости в более крупные лимфатические сосуды.
Стенка лимфатических сосудов состоит из трех слоев: внутреннего слоя эндотелиальных клеток, среднего мышечного слоя и внешнего слоя соединительной ткани. В лимфатических сосудах гораздо больше клапанов, чем в венозных, при этом циркуляция лимфы полностью зависит от сжатия сосудов окружающими мышцами. Лимфатические сосуды дренируют лимфу в лимфатические узлы.
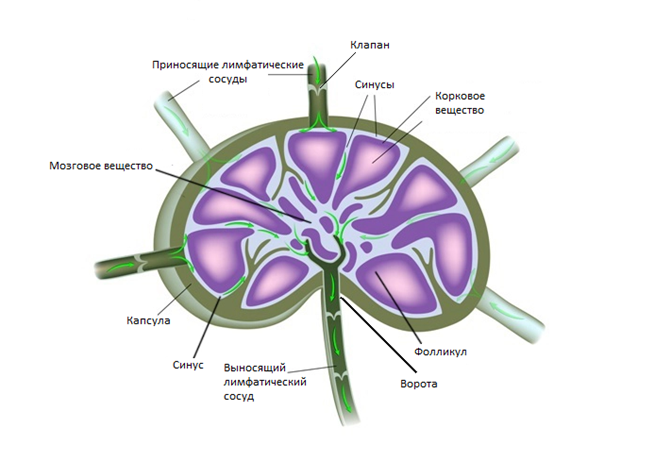
В среднем на каждой стороне шеи расположено до 75 лимфатических узлов. Снаружи узел покрывает капсула, под которой располагается субкапсулярные синусы – место куда попадает лимфатическая жидкость из приносящих лимфатических сосудов. Жидкость проходит сквозь ткань лимфатического узла, которая состоит из коркового и мозгового вещества, а затем выходит через ворота лимфатического узла и попадает в отводящие лимфатические сосуды. В итоге лимфа попадает в венозную систему в месте соустья внутренней яремной и подключичной вены.
Анатомическая структура лимфатического узла (Alila Medical Media/ Shutterstock ©)
Классификация лимфатических узлов шеи
На данный момент во всем мире рекомендована к использованию классификация Американского объединенного комитета по раку (American Joint Committee on Cancer (AJCC)) 8 издания от 2018 года:
Уровни лимфатических узлов шеи (Tenese Winslow LLC ©)
Диагностика
Осмотр
При пальпации шеи врач обращает внимание на расположение, размер, плотность и подвижность каждого узла. Особое внимание уделяется узлам, которые кажутся фиксированными к подлежащим сосудисто-нервным структурам и внутренним органам. Описание каждого узла становится важной частью медицинской документации, которая в дальнейшем может использоваться для оценки эффекта лечения.
Лучевые методы
Преимуществами УЗИ перед другими методами визуализации являются цена, скорость исследования и низкая лучевая нагрузка на пациента.
Ультразвуковыми признаками метастатического поражения лимфатических узлов может быть образование сферической формы, нарушение структуры, нечеткие границы, наличие центрального некроза и др.
Поскольку не всегда по УЗИ можно с уверенностью сказать является лимфатический узел пораженным или нет, иногда одновременно выполняют тонкоигольную аспирационную биопсию под ультразвуковым контролем с последующим цитологическим исследованием материала из этого узла. Результат цитологического исследования зависит от навыков врача УЗИ и качества образца (т.е. наличия достаточного количества репрезентативных клеток).
С появлением систем высокого разрешения и специальных контрастных веществ КТ позволяет обнаруживать лимфатические узлы, которые могли быть пропущены при иных методах диагностики.
Ценность МРТ – превосходная детализация мягких тканей. МРТ превосходит КТ в качестве предпочтительного исследования при оценке ряда новообразований головы и шеи, таких как основание языка и слюнные железы. Размер, наличие нескольких увеличенных узлов и центральный некроз – критерии, общие для протоколов исследования КТ и МРТ.
Этот новый метод визуализации все чаще используется для определения стадии опухолей головы и шеи. Метод основан на поглощении 2-фтор-2-дезокси-D-глюкозы (ФДГ) метаболически активными тканями. Исследование также может быть объединено с КТ, чтобы улучшить разрешение получаемого изображения и более точно определить расположение образования.
Биопсия
Биопсия — это удаление небольшого кусочка ткани для исследования под микроскопом или для тестирования в лаборатории на предмет наличия признаков злокачественности. В подавляющем большинстве случаев проводится тонкоигольная аспирационная биопсия. Врач, выполняющий биопсию, может использовать УЗИ или КТ для выполнения процедуры. Иногда тонкоигольная аспирационная биопсия не позволяет поставить окончательный диагноз, и требуются другие виды биопсии, такие как трепан-биопсия или эксцизионная биопсия.
 |  |
| Процесс приготовления предметных стекол для цитологического исследования. Материалом служит содержимое шприца после выполнения тонкоигольной аспирационной биопсии | |
План лечения
После определения диагноза и проведения всех диагностических исследований врач порекомендует оптимальный для пациента курс лечения. В конечном итоге лечение метастатического поражения лимфатических узлов зависит от типа и локализации первичной опухоли.
Существует три различных варианта лечения, которые могут быть использованы отдельно или в комбинации:
Хирургическое лечение
Хирургическое лечение обычно включает удаление лимфатических узлов шеи (лимфодиссекция) и последующее гистологическое исследование для точного определения стадии, так как это может существенно повлиять на дальнейшую тактику лечения. Хоть и не всегда, но чаще всего лимфодиссекция выполняется одновременно с удалением первичной опухоли.
Существуют различные виды лимфодиссекций:
Лучевая терапия
Лучевая терапия может быть назначена в качестве самостоятельного метода лечения в послеоперационном периоде, чтобы снизить вероятность рецидива либо в комбинации с химиотерапией в качестве самостоятельного или адъювантного лечения. Обычно адъювантная лучевая терапия необходима, если по результатам гистологического исследования обнаруживается несколько пораженных лимфатических узлов.
Химиотерапия
Химиотерапия обычно добавляется к лучевой терапии в качестве самостоятельного или адъювантного (послеоперационного) лечения. В некоторых случаях может использоваться индукционная химиотерапия с целью уменьшения объема образования и последующего хирургического вмешательства.
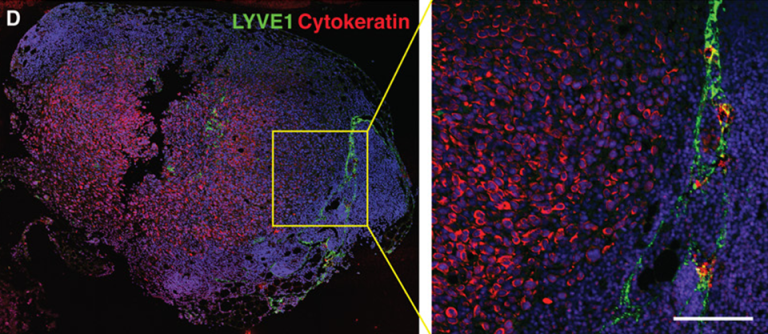
Иммунофлюоресцентная визуализация метастатически пораженного лимфатического узла с окраской на Цитокератин (красный) – маркер характерный для опухолевых клеток эпителиального происхождения. Масштабная линейка: 50 мкм
(Science Advances/Michael Detmar Group ©)
Прогноз
Метастазы в лимфатические узлы шеи могут возникать при онкологических заболеваниях различных локализаций, поэтому давать прогностические оценки для этой группы пациентов следует только после выявления первичной опухоли.
Факторы, влияющие на прогноз:
Наблюдение после лечения
Пациенты должны регулярно посещать своего специалиста по опухолям головы и шеи для оценки состояния на предмет любых признаков рецидива заболевания.
Стандартный график наблюдения
В первые 1–2 года осмотр и сбор жалоб рекомендуется проводить каждые 3–6 месяца, на сроке 3–5 лет – один раз в 6–12 месяцев. После 5 лет с момента операции посещать врача необходимо один раз в год или при появлении жалоб. У пациентов с высоким риском рецидива перерыв между обследованиями может быть сокращен.
Список литературы:
Авторская публикация:
Амиров Николай Сергеевич
Клинический ординатор НМИЦ онкологии им. Н.Н. Петрова
Под научной редакцией:
Раджабова З.А.
Заведующий отделением опухолей головы и шеи
НМИЦ онкологии им. Н.Н. Петрова,
врач-онколог, научный сотрудник, кандидат медицинских наук, доцент
Опухоли средостения: что это такое, классификация.
Опухоли средостения – общее название новообразований, которые расположены в медиастинальном пространстве груди. В 40% случаев диагностирования опухоли являются злокачественными, и тогда ставится диагноз рак средостения. Все опухоли делятся на две большие группы – первичные и вторичные. В первом случае речь идет о тех новообразованиях, которые формируются непосредственно в области средостения, во втором – опухоли образуются сначала в тканях, расположенных вне обозначенной области, а рак средостения развивается уже из метастаз. Иногда опухоли средостения называют рак тимуса, но это не совсем корректное обозначение диагноза. Дело в том, что он обозначает наличие злокачественных клеток в вилочковой железе, тогда как опухоли средостения могут начать свой рост и из других структур.
В зависимости от локализации опухоли различают следующие виды злокачественных новообразований:
Злокачественные новообразования средостения диагностируются чаще всего в возрасте 18-45 лет, какой-то гендерной предрасположенности не отмечается.
Отдельно в медицине рассматриваются мезенхимальные опухоли – представляют собой рак мягких тканей, к таковым относятся липомы и гемангиомы, лейомиосаркомы и фибромы. Поражают разные части средостения, относятся к группе вторичных, потому что «вырастают» из метастаз.
К редким опухолям средостения относятся липо- и фибросаркомы. Их опасность заключается в том, что они долгое время протекают бессимптомно и пациент обращается за помощью к врачу при выраженных нарушениях, когда рак находится уже на 3 и 4 стадии развития. Также к этой группе относится рак тимуса (тимома) – развивается в клетках вилочковой железы.
Какие симптомы укажут на рак средостения?
Рак может протекать в двух стадиях – бессимптомной и с выраженными признаками. Продолжительность прогрессирования опухоли средостения без симптомов зависит от нескольких факторов – место локализации новообразования, уровень общего иммунитета, возраст человека. Часто бессимптомно протекающий рак диагностируется случайно, во время проведения стандартной процедуры флюорографии в рамках диспансеризации.
К основным признакам рака средостения относятся:
Злокачественные опухоли растут достаточно быстро, поэтому переход из бессимптомной стадии в форму с выраженной клинической картиной недолгий. Могут проявляться и дополнительные симптомы типа отечности верхней части туловища и лица, синюшного цвета лица, расширения подкожных вен шеи.
Самым ранним проявлением рака средостения считается болевой синдром, особенно часто он проявляется при раке тимуса. В таком случае боли идентичны приступам стенокардии. Существует и ряд специфичных признаков опухолей средостения:
Общие симптомы, слабовыраженная клиническая картина, многообразие признаков, которые присущи и другим патологиям, делают диагностику только по жалобам пациента и стандартным обследованиям практически невозможной. Кроме этого, опухоли средостения могут быть и доброкачественными – например, рак тимуса по своей клинической картине полностью идентичен признакам доброкачественных новообразований в вилочковой железе.
Диагностика опухоли средостения.
Опухоль средостения может быть диагностирован инструментальными методами, которые являются самыми информативными:
Если перечисленных обследований недостаточно, то назначается хирургическая биопсия. Морфологическое исследование биологического материала позволяет полностью охарактеризовать рак средостения. Эта манипуляция важна для классификации опухоли – будет ли диагностирован именно рак тимуса или опухоль представляет собой доброкачественное образование.
Если есть подозрение на тимому (рак тимуса), то целесообразно проводить ультразвуковое исследование. Оно не выявит опухоль средостения, но даст возможность оценить состояние лимфатических узлов и жировой ткани в подключичной области.
К общим методам диагностики относятся анализы крови (общий, биохимический, коагулограмма), анализ мочи (общий), ЭКГ.
Лечение опухолей средостения.
Самым эффективным методом лечения опухолей средостения считается его хирургическое удаление, которое всегда сопровождается и специфической терапией. Если диагноз был поставлен на ранней стадии, врач может четко определить размер и форму опухоли, то применяется радиохирургический метод ее удаления по системе КиберНож. В случае больших размеров опухоли средостения удаляются классическим хирургическим методом с последующей химиотерапией. Диагностирование рака на поздней стадии делает нецелесообразным оперативное удаление новообразования, поэтому пациенту назначают только поддерживающее лечение (химиотерапия или лучевая) – рак средостения прекращает стремительно разрастаться, снижается вероятность распространения метастаз, облегчается симптоматика.
Если диагностирован рак тимуса (тимома), то врач опирается на данные исследований – каков размер опухоли средостения, есть ли ее разрастание. В некоторых случаях сначала проводится несколько курсов химиотерапии и только после этого назначается хирургическое лечение. Дополнительно, после проведения операции по удалению опухоли средостения, пациенту назначают гормональные препараты, иммуноподдерживающие средства.
Принимать решение о проведении терапевтического лечения или хирургического удаления опухоли средостения может только лечащий врач. Операция выполняется только в том случае, если специалист будет уверен в том, что он сможет удалить сразу все новообразование. Так как диагноз рак средостения часто ставится на поздних стадиях заболевания, то даже хирургические методы могут быть бесполезными по причине распространения метастаз, поражения внутренних органов и мягких тканей вокруг средостения.
Прогноз рака средостения.
Теоретически прогнозы на выздоровление при диагностировании опухоли средостения (рака тимуса) положительные. Но проблема заключается в сложностях диагностики – клиническая картина не типичная для злокачественных образований, часто люди либо предпринимают попытки лечения сами, либо обращаются со стандартными жалобами к врачу и им ставят неверный диагноз. Пока проводится лечение неверного заболевания, время проходит и наступает рак, средостения достигает тяжелой стадии. При своевременном выявлении рака тимуса вероятность благоприятного исхода составляет 68%.
Опухоли средостения (рак тимуса) возможно вылечить, но при условии своевременного выявления. Хирургический метод и последующая химиотерапия дают возможность полностью выздороветь. По причине неспецифической клинической картины диагностирование на ранней стадии затруднено, поэтому важно проходит диспансеризацию – это реальный шанс полностью избавиться от злокачественных образований.
Филиалы и отделения, в которых лечат опухоль средостения (рак тимуса)
МНИОИ им. П.А. Герцена – филиал ФГБУ «НМИЦ радиологии» Минздрава России.
В Отделе торакоабдоминальной онкохирургии
Заведующий отделом – д.м.н. А.Б. РЯБОВ
В Отделении торакальной хирургии
Контакты: (495) 150 11 22
МРНЦ им. А.Ф. Цыба – филиал ФГБУ «НМИЦ радиологии» Минздрава России.
Заведующий Отделом торакоабдоминальной онкологии – д.м.н. В.Ю. СКОРОПАД
Синдром увеличенных лимфатических узлов как педиатрическая проблема
Причиной увеличения лимфоузлов в большинстве случаев являются процессы, не связанные с гемобластозами: чаще всего это общепедиатрические, инфекционные, иммунные и другие состояния Тот факт, что врач-педиатр достаточно часто обнаруживает у своих
Причиной увеличения лимфоузлов в большинстве случаев являются процессы, не связанные с гемобластозами: чаще всего это общепедиатрические, инфекционные, иммунные и другие состояния
Тот факт, что врач-педиатр достаточно часто обнаруживает у своих пациентов увеличенные лимфатические узлы (ЛУ) и ему приходится в сжатые сроки находить ответ на вопросы «почему?» и «что делать?», позволяет обойтись без длинного введения. Так, при проведении педиатрического скрининга и последующего анализа 1607 диагнозов острых и хронических заболеваний у детей и подростков в возрасте 5 — 17 лет выявлено, что болезни ЛУ обнаружены в 3,35% случаев [6]. Традиционно при обнаружении увеличенных ЛУ, не учитывая другие составляющие этого синдрома (анамнез, общую клиническую картину, местную симптоматику), педиатр думает об онкогематологическом заболевании. Вследствие этого такие больные составляют 40% всех пациентов онкогематологов [7], что представляется неоправданным. Частота впервые выявленных случаев онкогематологических заболеваний в нашей стране невелика. Заболеваемость острыми лейкозами составляет 4,0 — 5,0 случаев на 100 000 детей в год, неходжкинскими лимфомами — 0,9 — 1,1 на 100 000 детей в год. Отсюда понятно, почему подавляющая масса детей с увеличенными ЛУ с приемов гематологов возвращаются к педиатрам с диагнозом лимфаденит. То есть причиной увеличения ЛУ в большинстве случаев являются процессы, не связанные с гемобластозами: общепедиатрические, инфекционные, иммунные и другие состояния. Исходя из вышесказанного, мы решили представить нашу точку зрения на синдром увеличения лимфатических узлов.
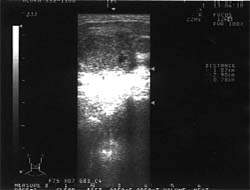 |
| Рисунок 1. Подчелюстные лимфатические узлы при лимфогранулематозе (УЗИ, 7,5 МГц) |
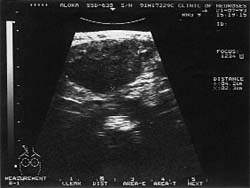 |
| Рисунок 2. Подчелюстной узел при туберкулезе (УЗИ, 7,5 МГц) |
Увеличение ЛУ может быть результатом лимфаденита (ЛА) и лимфаденопатии (ЛАП).
ЛА — воспаление лимфатических узлов, возникающее как осложнение после различных гнойно-воспалительных заболеваний и специфических инфекций (туберкулез, актиномикоз, чума и др.). ЛА, как правило, представляет собой вторичный процесс.
ЛАП — системное увеличение лимфатических узлов, не связанное с воспалением (воздействие некоторых медикаментов, пролиферация, метастазирование и т. п.).
Эпидемиология ЛА и ЛАП не разработана. Можно только отметить, что, по данным И. С. Тарасовой [6], при сплошных массовых исследованиях детей Брянской области ЛА встречается, как и следовало ожидать, несколько чаще (1,86% среди всех осмотренных), чем ЛАП (1,49% от общего контингента).
Методы исследования ЛУ должны быть максимально стандартизованы. В клинической практике оценивают жалобы (местная болезненность, местное или общее повышение температуры, общесоматические жалобы), анамнез (эпиданамнез, давность появления, локализация увеличенных ЛУ в одной или нескольких группах, одновременное их увеличение или постепенное, скорость манифестации болезни и т. д.). Особое значение имеет осмотр больного. Наряду с тщательным общепедиатрическим осмотром по системам необходимо обратить внимание на число измененных ЛУ и их локализацию по группам. Размеры лимфоузлов должны оцениваться только объективно: в миллиметрах или сантиметрах. Принятое в нашей стране и широко рекомендуемое в отечественной литературе сравнение размеров ЛУ с зерном, горохом, вишней, лесным или грецким орехом нерационально, дает несопоставимые результаты и должно быть изжито. Необходимо тщательно фиксировать соотношение увеличенных ЛУ между собой. Например, расположение ЛУ по типу «солнечной системы» (один большой ЛУ в центре и по периферии от него ЛУ меньшего диаметра) типично для туберкулезного лимфаденита [2]. ЛУ могут быть эластичными, плотными, с явлениями флюктуации. Обязательно описывается спаянность ЛУ с соседними узлами и окружающими тканями, наличие или отсутствие болезненности при пальпации. Необходимо осмотреть и описать состояние всех доступных ЛУ: затылочных, подчелюстных, передних и задних шейных, над- и подключичных, подмышечных, локтевых, паховых, подколенных. Данные осмотра и пальпации дополняются, подтверждаются и уточняются инструментальными методиками. Прежде всего это методы неинвазивной визуализации, использующиеся для изучения глубоко расположенных ЛУ. Они позволяют точно определить размеры ЛУ, изменения групп ЛУ, недоступных осмотру и пальпации, характеристики капсулы, спаянность, топографические особенности, внутреннюю структуру; исключить состояния, симулирующие увеличение ЛУ (опухоли, не исходящие из ЛУ, гематомы, аномалии почек и т. п.). Крайне важно получение информации о состоянии печени и селезенки. На первом месте по доступности и быстроте получения информации стоит эхография (УЗИ). ЛУ диаметром менее 1,5 см по плотности приближаются к окружающей жировой ткани, визуализируются редко, ограничить их опухолевое поражение от иных причин увеличения только по данным УЗИ практически невозможно. Такие ЛУ наблюдаются прежде всего при инфекционных процессах, реактивных поражениях, а у детей с гемобластозами — в состоянии полной ремиссии. ЛУ диаметром 1,5 — 2 см хорошо визуализируются в случае, если они проецируются на эхонегативные структуры или изменяют обычные топографо-анатомические соотношения. Весь спектр УЗИ-изменений может быть сведен к нескольким основным группам [3].
1. Увеличение отдельных ЛУ оценивается как небольшое, если они не теряют своей обычной УЗИ-картины, сохраняют капсулу, четкость и ровность контура, не изменяют топику органа. Такой тип характерен для инфекционных поражений, особенно туберкулеза, вирусного гепатита, коллагенозов, иммунодефицитов, гемобластозов у детей низкой группы риска.
2. Дальнейший рост ЛУ приводит к появлению сливающихся между собой масс, оттесняющих сосуды. Наблюдается при гнойном расплавлении группы лимфоузлов, при гемобластозах, метастазирующих опухолях.
3. Сдавление или оттеснение внутренних органов. При этом может возникнуть гидронефроз за счет сдавления мочеточников, значительное смещение матки, мочевого пузыря. Типично для крайне неблагоприятных вариантов миелолейкозов, лимфом Ходжкина и неходжкинских лимфом.
УЗИ-заключения могут быть подтверждены компьютерной томографией (КТ). Дополнительно КТ позволяет уточнить структуру ЛУ, их топографические соотношения, обнаружить другие группы ЛУ.
Если поверхностные лимфоузлы есть смысл оценивать только эхографически, а мезентериальные и забрюшинные ЛУ практически одинаково хорошо выявляются методами УЗИ и КТ, то внутригрудные ЛУ выявляются почти исключительно рентгенологически.
| Принятое в нашей стране и широко рекомендуемое в отечественной литературе сравнение размеров лимфоузлов с зерном, горохом, вишней, лесным и грецким орехом нерационально, дает несопоставимые результаты и должно быть изжито |
Такие методы диагностики, как изотопная сцинтиграфия и лимфография, могут применяться по очень строгим показаниям в специализированных клиниках или ограниченно при динамических исследованиях и не используются в широкой практике.
Достоверное выявление причин увеличения ЛУ возможно лишь гистологическими методами. При этом материал должен быть получен только путем открытой биопсии ЛУ, хотя современные методики тонкоигольной биопсии позволяют получить достоверные результаты. Рекомендовавшаяся ранее пункционная биопсия дает очень большой процент ложно-положительных и ложноотрицательных результатов.
Увеличение ЛУ схематически [5, 11] можно представить (с описанием некоторых практически значимых, но малоизвестных форм) как связанное с инфекцией (ЛА) и не связанное с инфекцией (ЛАП).
1. ЛА вирусной природы.
2. ЛА при бактериальных инфекциях.
3. ЛА при грибковых заболеваниях.
4. ЛА при паразитарных заболеваниях.
5. ЛА при протозойных инфекциях.
Формы, не связанные с инфекциями (ЛАП)
1. ЛАП медикаментозная.
2. При системных процессах в организме.
3. Гранулематозы
4. ЛАП при гемобластозах.
5. ЛАП при метастазировании солидных опухолей в ЛУ.
6. Паранеопластические реакции [12].
7. ЛАП при первичных иммунодефицитных состояниях (ПИД).
8. Генетически обусловленные ЛАП [9].
9. Синдром приобретенного иммунодефицита (СПИД).
В процессе диагностики заболеваний, протекающих с увеличением ЛУ, объединяются усилия педиатров, инфекционистов, иммунологов, онкогематологов. Главная роль при этом отводится именно педиатру, так как большинство ЛА и ЛАП связано у детей с инфекционным процессом. В то же время нельзя настаивать на инфекционном генезе увеличения ЛУ, если двухнедельный курс антибиотикотерапии не привел к существенному улучшению клинико-лабораторной и инструментальной картины. В пользу онкогематологического генеза изменения ЛУ свидетельствует увеличение их диаметра до 4 см и более, каменистая плотность, бугристость, образование конгломератов ЛУ, их спаянность с окружающими тканями, внутригрудные конгломераты, особенно в верхнем средостении, внутрибрюшинные конгломераты.
Четкое знание многообразия причин увеличения ЛУ поможет педиатрам в диагностике и дифференциальной диагностике этого синдрома.