Края резекции интактны что значит
Базальноклеточный рак кожи (базалиома)
Тел.: 8-800-25-03-03-2
(бесплатно для звонков из регионов России)
Санкт-Петербург, наб. реки Фонтанки, д. 154
Тел.: +7 (812) 676-25-25
Санкт-Петербург, В.О., Кадетская линия, д. 13-15
Тел.: +7 (812) 676-25-25
Санкт-Петербург, ул. Циолковского, д.3
Тел.: +7 (812) 676-25-10
Базальноклеточный рак кожи (БКРК) относится к немеланомным опухолям, так как развивается из эпителиальных клеток базального слоя эпидермиса.
На данный момент различают две наиболее распространенных формы: поверхностная и узловая
Поверхностный (впервые выявленный) БКРК:
чаще развивается на коже туловища и конечностей;
у пациентов более молодого возраста, с преобладанием женщин.
Важно!
чаще развивается на коже головы
у пациентов пожилого и старческого возраста
Почему появляется и как развивается?
Не существует единого фактора происхождения или причины для развития всех форм базальноклеточного рака кожи (БКРК). Общие факторы, которые влияют на возникновение и развитие БКРК и других новообразований: ссылка.
Однако считается, что основной фактор, вызывающий развитие заболевания — ультрафиолетовое излучение.
Насколько распространено это новообразование кожи?
Опухоли кожи занимают второе место в онкологической заболеваемости населения планеты. И БКРК является наиболее распространенным злокачественным новообразованием среди них.
БКРК составляет почти 80% от всех впервые выявленных злокачественных новообразований кожи.
Однако в реальности, значительное количество базалиом не диагностируется на ранних стадиях ввиду длительности развития процесса, скрытого течения заболевания пожилого и старческого возраста пациентов, не желающих обращаться к специалисту, а также в связи с отсутствием метастазирования и тяжелых осложнений.
К сожалению, заболеваемость БКРК ежегодно увеличивается на 4-8%. По данным НМИЦ онкологии им. Н. Н. Петрова, в 2016 году, в структуре среди всех выявленных злокачественных новообразований рак кожи составил у женщин 9.93 %, а у мужчин 7.05%, в то время как в 1995 году эти показатели составляли 5.5% и 3.9%, соответственно.
Вам будет любопытно, что по данным ВОЗ (2017 г.) в Австралии, стране с наиболее высокими показателями заболеваемости злокачественных новообразований кожи, две трети населения в течении жизни заболевают БКРК. А в США 1\3 всех онкологических заболеваний приходится на рак кожи, из них 80% составляет БКРК.
Еще необходимо отметить значительные колебания показателей заболеваемости раком кожи в структуре злокачественных новообразований, в различных регионах мира и России в частности, в зависимости от национальных, климатических особенностей и урбанизации в целом.
Чаще всего БКРК встречается в южных регионах, хотя высокая мобильность населения, в последнее время, приводит к тому, что показатели заболеваемости северных народов также неуклонно растут, причем у женщин стабильно выше, чем у мужчин. Максимальных значений заболеваемость БКРК достигает у лиц старше 60 лет, Однако, в последние десятилетия существенно увеличилось количество пациентов молодого возраста. Их доля будет продолжать расти, что обусловлено увеличением продолжительности жизни, миграцией людей по регионам планеты, возрастанием интенсивности естественного УФ излучения в связи с экологическими факторами и более частым использованием искусственного ультрафиолета.
При этом, несмотря на высокую заболеваемость, уровень метастазирования и смертности с поправкой на возраст оценивается лишь от 0,0028% до 0,5% и 0,12 % на 100000 населения, соответственно.
Клинические признаки базальноклеточного рака кожи
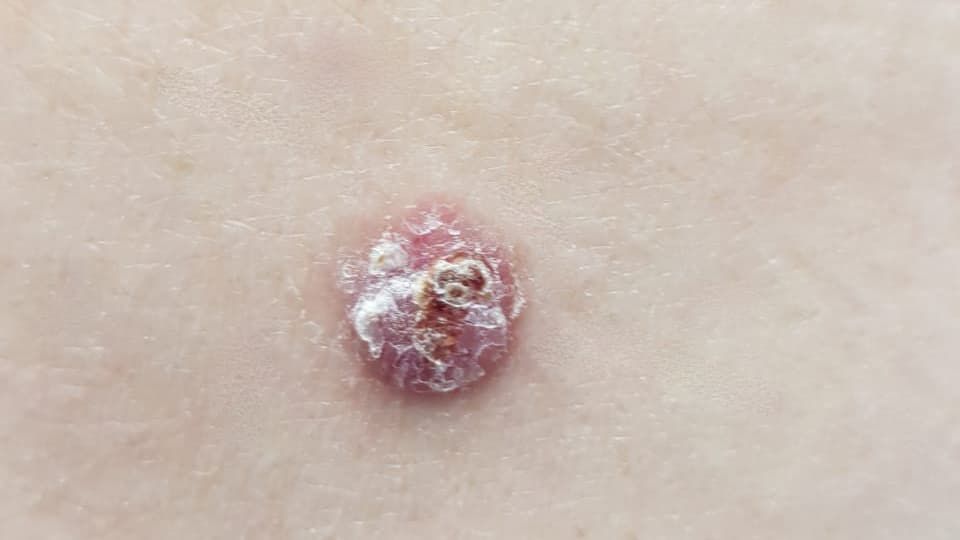
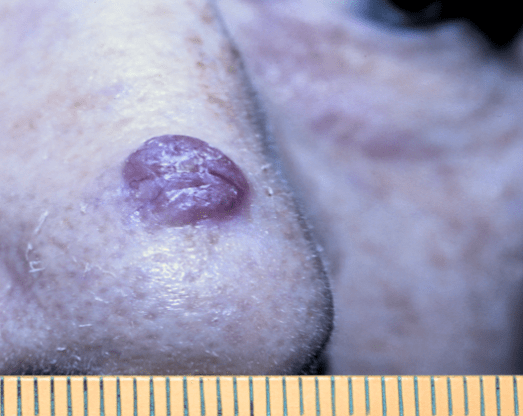
Поверхностная форма — наименее агрессивная из всех «карцинома» заставляет пациента обратиться к врачу, когда опухоль представляет собой уже достаточно значимый косметический дефект или начинает доставлять неудобство в связи с присоединением изъязвления. Поверхностную форму БКРК, также еще называют базалиомой туловища и конечностей. На туловище, чаще всего, имеет множественный характер. Преобладает радиальный, крайне медленный рост опухоли, занимающий площадь в нескольких сантиметров до начала инвазии и подтверждения диагноза. Данная форма часто рассматривается специалистом как поверхностная кератома и игнорируется у лиц старческого и пожилого возраста. Визуально определяется как плоское, розовато-коричневатое, слегка шелушащееся образование, с пальпаторно едва определяемым валикообразным краем, нитевидно-расположенными узелками по типу «жемчужного ожерелья» по периметру опухоли, перламутровым цветом и, иногда, визуализирующимися телеангиоэктазиями.
Центр узла часто изъязвляется с последующим формированием струпа и гиперкератоза. Валик по периметру, часто определяется также классическим «жемчужным ожерельем».
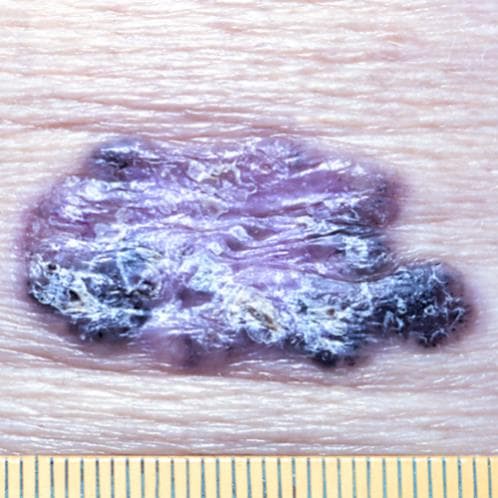
Склеродермоподобная / склерозирующая форма БКРК. Наименее распространенная, но наиболее агрессивная форма. Образование кожи напоминает рубец, бледно-желтого цвета, восковидный пальпаторно, глянцевый. При этом характерная в целом для базалиом «нитка жемчуга» и телеангиоэктазии чаще всего отсутствуют. Крайне часто рецидивирует, в связи с распространением опухоли как по площади, так и в глубину (феномен «айсберга»). Очень часто заболевание длительное время не диагностируется в виду его атипичной картины.
При изъязвленном базальноклеточном раке пациенты жалуются на мокнутие и кровоточивость при самых ранних стадиях опухоли, отсутствие болезненности, которые нарастают соразмерно увеличению очагу поражения. В дальнейшем присоединяется вторичная инфекция, что может увеличивать визуально площадь поражения. При возникновении данной формы опухоли на конечностях, чаще всего длительно рассматриваются врачами первичного звена как трофические язвы у лиц старческого возраста, даже при отсутствии других клинических признаков хронической венозной недостаточности.
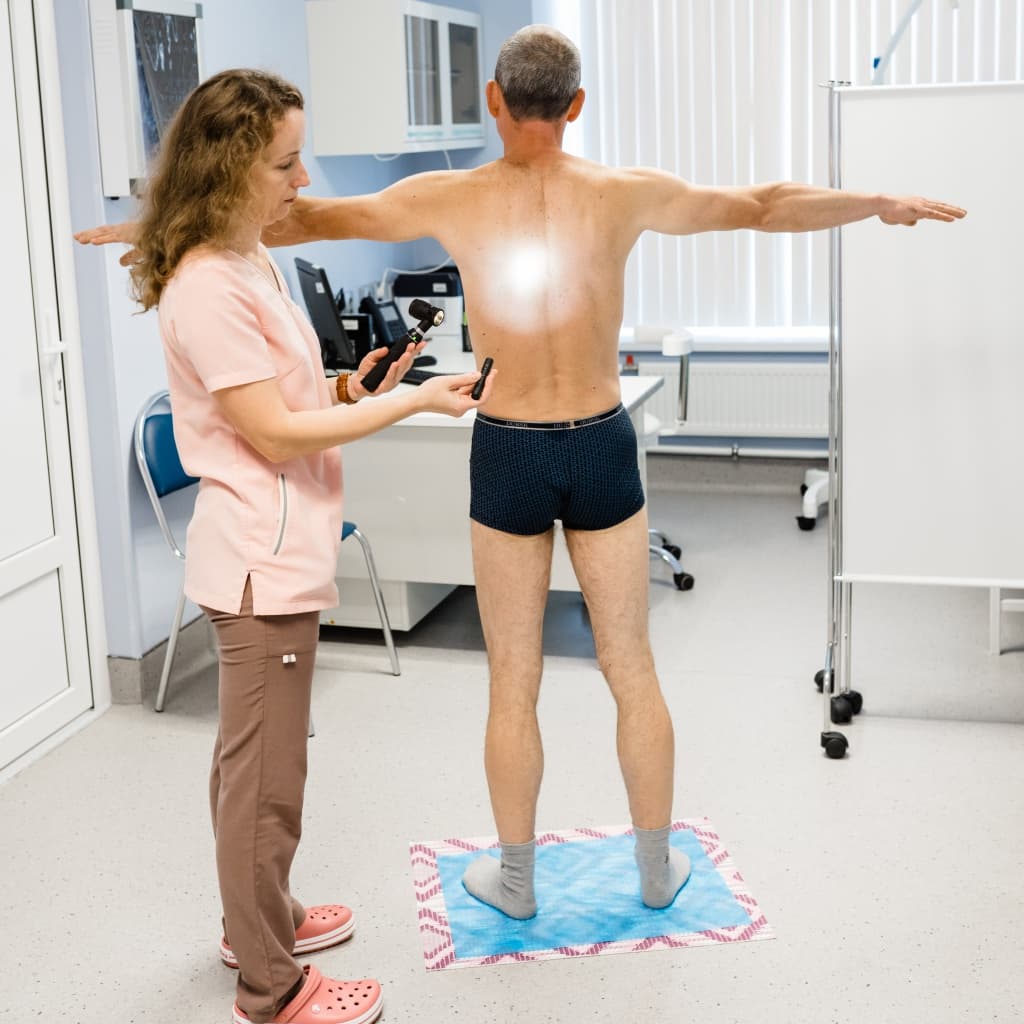
При общем осмотре пациента врач-онкодерматолог
Смотрит ВСЕ! Кожу на туловище, лице, шее, конечностях, слизистые, волосистую часть головы.
Края резекции интактны что значит
Рак молочной железы (РМЖ) в настоящее время занимает лидирующее место среди заболеваний женского населения планеты, особенно в возрастной группе старше 50 лет. Так, из 10 млн выявляемых в мире онкологических заболеваний РМЖ составляет > 10%, а за последнее десятилетие данная патология превзошла по частоте встречаемости рак шейки матки. Консервативная хирургия по сохранению груди с последующим облучением всей груди является стандартным вариантом лечения рака молочной железы (РМЖ) на ранней стадии на протяжении уже более 25 лет. Со временем частота местных рецидивов (в сроки до 10 лет) неуклонно снижалась и в настоящее время составляет 2 см [8, c. 990].
Также имеются другие факторы, кроме края резекции, которые влияют на частоту рецидивов. В метаанализе, включившем 7174 пациента, получавших органосохранную хирургию и ЛТ, относительный риск (ОР) развития местного рецидива у пациентов с опухолями, экспрессирующими гормональные рецепторы или HER2, составил 0,49 (95%-ный доверительный интервал [ДИ] 0,33–0,73) по сравнению с пациентами с тройным негативным раком (OP=0,33) [9, c. 840]. Влияние биологии опухоли на местный рецидив настолько глубокое, что статистически значимые различия в частоте наблюдаются среди опухолей размером 1 см и менее в зависимости от рецептора эстрогена (РЭ), рецептора прогестерона (РП) и статуса HER2 [10, c. 715]. Даже в подгруппе пациентов с отрицательными лимфоузлами, но с положительными РП и отрицательным HER2 показаны химиотерапия и тамоксифен – Mamounas и соавт. [11, c. 1682].
Другим фактором, существенно влияющим на частоту локального рецидива, является широкое применение адъювантной системной терапии. В одном метаанализе было показано, что тамоксифен в течение 5 лет уменьшил ОР рецидива до 0,47 по сравнению с плацебо (ОР=0,63) [12, c. 2091]. Достижения таргетной терапии также улучшили результаты выживаемости. Например, применение ингибиторов ароматазы или продолжительной гормональной терапии снизило ОР локального рецидива с 0,83 до 0,50 по сравнению с только тамоксифеном [13, c. 22]. Добавление трастузумаба к химиотерапии снижает ОР локального рецидива до 0,47 по сравнению с одной только химиотерапией, что приводит к снижению 3-летней частоты локального рецидива с 7% до 1% (р=0,01) [14, c. 1988]. В крупном анализе (n=86 598) пациентов, участвовавших в 53 рандомизированных исследованиях за период с 1990 по 2011 гг., доля локального рецидива в общем числе уменьшилась с 30% до 15% (p 2 см и клиническая болезнь N2 или N3 были статистически значимыми предикторами локального рецидива после органосохранного лечения РМЖ [30, c. 2303].
Все предостережения, касающиеся отсутствия стандартного подхода к патологической оценке полей при инвазивном раке, применимы к экстенсивным внутрипротоковым карциномам, а данные рандомизированных исследований уровня I о влиянии увеличения ширины полей на локальный рецидив отсутствуют. Существует несколько причин, по которым оптимальная ширина полей для этого типа может отличаться от инвазивного рака. Было продемонстрировано, что экстенсивная внутрипротоковая карцинома развивается в протоках прерывисто, что способствует возникновению остаточной опухоли. Поэтому ретроспективные исследования показали, что отрицательный край резекции ≥ 1 см и ЛТ снижают частоту локального рецидива. Это служило основой решения SSO, ASTRO и ASCO о разработке междисциплинарного, основанного на фактических данных консенсусного руководства для этих типов рака в 2015 г. Это руководство опирается на большой метаанализ, который включал 7 883 пациента в 20 исследованиях и 865 случаев локального рецидива. Медиана наблюдения составила 78,3 месяца, а частота локального рецидива – 8,3% [31, c. 3811]. Из-за неоднородности исследований был проведен как частотный, так и байесовский сетевой анализ, который подтвердил, что отрицательные поля по сравнению с положительными полями уменьшили риск локального рецидива примерно на 50%.
Заключение. Таким образом, рак молочной железы остается актуальной проблемой в онкологии. Несмотря на имеющиеся достижения, результаты еще остаются не вполне удовлетворительными. На результаты лечения влияют многие факторы, такие как биологические особенности опухоли, стадия опухолевого процесса, гормональный статус, возраст, гистологическая структура опухоли, выбор метода лечения и др. В последнее время мастэктомию упорно вытесняют органосохранные операции. Такой консервативный подход с использованием лучевой и гормонотерапии с учетом гормонального статуса позволил достичь хороших результатов в лечении. Однако до сих пор нет единого мнения, каковы должны быть величины ширины размеров края резекции при ранних стадиях рака молочной железы. Обзор литературных данных показал, что, к сожалению, количество повторных иссечений еще наблюдается, несмотря на четкую маркировку операционного поля. Диапазон дискутируемой разными авторами ширины резекции широк и колеблется от 1 мм до 10 мм. Однако метаанализы многочисленных исследований показали, что отрицательным край должен считаться при ширине 2 мм и менее.
Контроль хирургических краев резекции при органосохраняющем лечении рака молочной железы
1 НИИ онкологии им. Н.Н. Петрова Минздрава Россиии,
2 Санкт-Петербургский государственный медицинский университет им. акад. И.П. Павлова МЗ РФ
3 Северо-Западный государственный медицинский университет им. И.И. Мечникова Санкт-Петербург, Россия
В настоящее время продолжаются споры по поводу определения «оптимального» хирургического края при органосохраняющем лечении (ОСЛ) рака молочной железы. Исторически основа данного спора берет начало от оригинальных испытаний, подтверждающих безопасность ОСЛ, и множества противоречивых ретроспективных исследований, пытавшихся за последние 20 лет определить связь между шириной хирургического края и отдаленными результатами.
Важно понимать, что оценка хирургического края является неточной, и современные лабораторные подходы к оценке краев резекции представляют собой только выборочную оценку краев. Имеющиеся в настоящее время данные свидетельствуют о том, что определение хирургического края при ОСЛ должно быть сделано с учетом биологических особенностей рака молочной железы, взаимосвязи биологии опухоли, адъювантной терапии и отдаленных результатов.
Достижение консенсуса по вопросам оценки хирургического края при ОСЛ должно быть клинически приоритетным, т.к. дает возможность снизить объем оперативного вмешательства на молочной железе без риска ухудшения отдаленных результатов лечения.
Ключевые слова: органосохраняющее лечение, рак молочной железы, резекция, хирургический край.
Органосохраняющее лечение (ОСЛ), включающее выполнение секторальной или сегментарной резекции с аксиллярной диссекцией или биопсией сторожевых лимфатических узлов, проведением последующей адъювантной лучевой терапии на молочную железу и системной терапии, стало распространенным подходом к лечению ранних стадий рака молочной железы [1, 2]. Многочисленные исследования показали очень высокую частоту развития местного рецидива (около 20% в течение 5 лет) рака молочной железы у пациентов, у которых не были достигнуты микроскопически чистые («негативные») края резекции при выполнении секторальной резекции, даже при проведении адъювантной лучевой терапии [3].
Полное хирургическое удаление рака молочной железы с достижением микроскопически чистых краев резекции является важным компонентом органосохраняющего лечения [3]. Продолжаются споры о значимости достижения «широких» микроскопических краев у пациентов, подвергавшихся ОСЛ, с целью улучшения отдаленных результатов и сокращения частоты рецидивов [4].
Некоторые хирурги стремятся достичь более широких хирургических краев с целью гарантированного удаления остаточной опухоли и улучшения результатов лечения [5]. Однако целью органосохраняющего лечения является сохранение объема и формы молочной железы и по возможности минимизация объема удаленной ткани вокруг опухоли, которая связана с минимальным риском рецидива [3].
«Оптимальный» хирургический край для удаления опухоли определяют как минимальную ширину нормальной ткани вокруг опухолевого узла, ассоциирующуюся с низкой частотой рецидивов и высокими показателями выживаемости при условии проведения современной адъювантной терапии. Исходя из этого определения, удаление объема ткани больше оптимального не улучшает результаты лечения и может ухудшить косметические результаты, повысить частоту повторных иссечений, затрат, вызвать беспокойство пациентов и отсрочку в адъювантной терапии [6].
Расстояние от края опухоли до хирургического края резекции («ширина края») во время резекции стало часто обсуждаемым метрическим параметром при лечении рака молочной железы. Тем не менее, нет единого мнения о том, как оптимально использовать этот параметр с целью оптимизации дальнейшего хирургического лечения [7]. Существует необходимость в разработке руководящих принципов в определении оптимального хирургического края при органосохраняющем лечении рака молочной железы.
Определение оптимального хирургического края имеет важное значение для минимизации избыточного лечения без негативного влияния на показатели выживаемости больных с ранними стадиями рака молочной железы. На сегодняшний день нет проспективных рандомизированных исследований, непосредственно касающихся влияния измеренной ширины краев резекции на результаты при органосохраняющем лечении по поводу инвазивного рака молочной железы или протокового рака in situ (DCIS).
В работе Gromyer и соавт. (2013) были рассмотрены фактические данные взаимосвязи между статусом краев резекции и результатами органосохраняющего лечения. Эти данные следует рассматривать с особой осторожностью, учитывая ограниченность существующих подходов к оценке краев резекции, наличие других клинических и биологических факторов, которые оказывают влияние на клинические исходы, а также факторов, связанных с остаточной опухолью после ее удаления.
Таблица 1. Рандомизированные исследования, сравнивающие отдаленные результаты
мастэктомии и секторальной резекции с последующей лучевой терапией.
| Исследование | Требование к краям резекции при лампэктомии | Период наблюдения (годы) | Общие различия в показателях выживаемости |
|---|---|---|---|
| Jacoson, 1995 [33] | Объем удаленной опухоли | 10 | NS |
| Arriogada, 1996 [34] | Ширина краев резекции 2 см | 14 | NS |
| Fisher, 2002 [2] | Гистологически негативные края резекции | 20 | NS |
| Van Dongen, 2000 [35] | Объем удаленной опухоли * | 13 | NS |
| Veronesi, 2002 [36] | Ширина крае в резекции 2–3 см, кожа, фасция | 20 | NS |
| Сокращения: NS – недостоверно, * – В целом, повторное иссечение применялось только в случае микроскопически определяемой (т.е. пальпируемой) опухоли. | |||
Инвазивный рак молочной железы
В таблице 1 приведены критерии хирургического края резекции, используемые исследователями в крупных рандомизированных испытаниях, которые стали основой современных принципов органосохраняющего лечения. Эти исследования значительно варьируют в определении минимальных критериев хирургического края резекции. Все исследования, проведенные в 1970-х и 1980-х годах, требовали по крайней мере полное удаление опухоли во время выполнения секторальной резекции. Они показали, что пациенты, перенесшие ОСЛ, имеют сопоставимые показатели общей выживаемости по сравнению с пациентами, подвергшимся мастэктомии.
Только в исследовании NSAP-06 [2] регистрировали ширину края резекции в операционных препаратах после секторальной резекции, но наличие только негативных краев резекции было достаточным критерием включения в исследование. Анализ результатов этих исследований показал, что различия в хирургических краях и, в частности, ширина хирургического края не являются факторами, определяющими выживаемость больных, перенесших ОСЛ по поводу инвазивного рака молочной железы.
После публикации проспективных исследований было проведено много ретроспективных исследований, изучавших понятие «близкий» край резекции и влияние эффекта «близких» краев резекции на отдаленные результаты [8]. В этих работах понятие «близкого» края различалось и определялось в каждом отдельном испытании (например, <1 мм или <2 мм). В некоторых исследованиях было показано, что при «близких» краях резекции частота рецидива схожа с теми больными, у которых отмечались «позитивные» края резекции [9].
Другие исследователи получили промежуточные результаты при близких краях резекции по сравнению с «позитивными» и «негативными». В ряде работ было показано, что «близкие» края по сравнению с широкими чистыми краями не оказывают никакого влияния на показатели безрецидивной выживаемости. Эта неопределенность побудила многих хирургов выполнять повторные резекции при «близких» краях в целях снижения угрозы местного рецидива (или улучшения показателей безрецидивной выживаемости). Указанные диапазоны местных рецидивов в течение 5 лет при чистых краях, близких краях и позитивных краях составили 2–3%, 2–8% и 10–25% соответственно [8].
Недавно сообщено о результатах мета-анализа 21 исследования по изучению взаимосвязи между статусом краев резекции и исходами для пациентов, подвергшихся органосохраняющему лечению по поводу инвазивного рака молочной железы [10]. Авторы показали, что несмотря на то, что увеличение ширины края резекции имеет слабую корреляцию с риском местного рецидива, эффект смягчается, когда вносятся коррективы при проведении адъювантной гормональной и лучевой терапии. Авторы приходят к выводу, что выбор широких краев резекции по сравнению с более узкими для достижения чистых краев резекции вряд ли имеет дополнительное преимущество при долгосрочном местном контроле после органосохраняющего лечения [10].
Дуктальная карцинома in situ
В двух крупных рандомизированных исследованиях у больных, получавших лучевую терапию после выполнения секторальной резекции по поводу DCIS (NSAP 17 и NSAP 24), края резекции были определены как патологически позитивные или негативные (т. е. опухоль не окрашивалась чернилами) [11]. В этих испытаниях была продемонстрирована низкая частота локальных рецидивов среди больных, получивших лучевую терапию, а самая низкая частота рецидивов была отмечена у пациентов с негативными краями резекции. В другом большом рандомизированном исследовании по лучевой терапии после выполнения секторальной резекции по поводу DCIS (EORTC 10853) позитивные хирургические края резекции были определены как расстояние от опухоли до края резекции, равное 1 мм или менее [12]. В данном исследовании при многовариантом анализе негативный статус краев резекции и проведение лучевой терапии были связаны со снижением риска местных рецидивов. У пациентов с позитивными краями резекции 10-летняя частота местных рецидивов достигала 39% без лучевой терапии и 24%, если она проводилась.
В исследовании Rudloff и соавт. (2010) сообщалось о ретроспективной группе из 294 пациентов, подвергшихся секторальной резекции по поводу DCIS с последующей лучевой терапией или без нее при среднем 11-летнем периоде наблюдения [13]. В этой группе был показан более высокий риск рецидива у пациентов с узкими (<1 мм) краями резекции. Десятилетняя частота местных рецидивов у пациентов, не получавших лучевую терапию, равнялась 42, 27 и 21% при ширине краев резекции менее 1 мм, от 1 до 9 мм и 10 мм или более соответственно. Было также продемонстрировано снижение частоты местных рецидивов у всех пациентов, получавших адъювантную лучевую терапию.
В мета-анализе данных на 4660 пациентов, получивших органосохраняющее лечение по поводу DCIS (секторальная резекция и адъювантная лучевая терапия), была продемонстрирована значительно более высокая частота рецидивов у пациентов с позитивными краями резекции, чем у пациентов с близкими или негативными краями резекции (р<0,01) [14]. Кроме того, при рассмотрении конкретных пороговых значений краев резекции при DCIS авторы установили пороговое значение, равное 2 мм. При размерах краев резекции более 2 мм отмечена незначительная дополнительная выгода в снижении частоты местных рецидивов.
Различия в определении «оптимальных» краев резекции и частоты повторных резекций при органосохраняющем лечении
В течение многих лет определение оптимального края резекции при ОСЛ является областью споров и дискуссий среди специалистов по лечению рака молочной железы [4, 8]. На сегодняшний день не существует единого консенсуса в определении оптимальных краев резекции. Имеются различные точки зрения среди радиологов и хирургов-онкологов, а также данных, приводимых врачами Северной Америки и Европы. В работе А. Taghian с соавт. (2005) сообщалось о результатах исследования, в котором были изучены подходы к хирургическим краям резекции при органосохраняющем лечении среди 1137 радиологов [5]. У респондентов были отмечены существенные различия в определении понятий «негативный» и «близкий» край резекции. Также отмечены значительные различия в ответах среди врачей Северной Америки и Европы. Более 50% респондентов считают «негативным» краем резекции при органосохраняющем лечении расстояние более 1 мм от окрашенных чернилами краев операционного материала. Были отмечены также различия в отношении рекомендаций для повторного иссечения краев резекции.
В нескольких исследованиях отмечались существенные различия между хирургами-онкологами в отношении их рекомендаций для повторного иссечения краев резекции как составной части органосохраняющего лечения. lair и соавт. (2009) проанализировали результаты исследования с участием 351 хирургов-онкологов в отношении минимально допустимой ширины краев резекции [15]. Авторы обнаружили существенные различия в рекомендациях относительно допустимой ширины хирургических краев как для инвазивного рака, так и для протокового рака in situ (DCIS). 65% хирургов считают приемлемой шириной краев резекции расстояние 2 мм или более, хотя 35% рассматривали приемлемой ширину края менее 2 мм. Аналогично, в исследовании Azu с соавт. (2010) обнаружены значительные различия в рекомендациях относительно безопасного края резекции. Более того, узкоспециализированные хирурги-онкологи рекомендовали менее широкие допустимые хирургические края [16]. Таким образом, в данных исследованиях были предложены значительные изменения в существующей практике для контроля хирургических краев при органосохраняющем лечении как инвазивного рака, так и DCIS молочной железы.
Несколько последних исследований показали существенные различия в частоте повторных резекций после секторальной резекции по поводу рака молочной железы в разных больницах и регионах. В исследовании McCahill с соавт. (2012) сообщалось о 2286 пациентах, подвергшихся секторальной резекции, 23% из которых потребовалось дополнительное оперативное вмешательство (повторная резекция) [7]. В этом исследовании различие в частоте повторных резекций было отмечено у пациентов с негативными патоморфологическими краями резекции. Оно составило от 1,7 до 20,9%. Хотя 47,9% пациентов с чистыми краями, но с шириной края резекции менее 1 мм подверглись повторному иссечению, только 20,2% пациентам с шириной краев резекции от 1,0 до 1,9 мм было выполнено повторное иссечение краев. Аналогично, в исследовании R. Jeevan с соавт. (2012) сообщалось о существенных различиях в частоте повторных резекций после секторальной резекции по поводу рака молочной железы среди специалистов Англии [17].
Микроскопическая остаточная опухоль в молочной железе после органосохраняющих операций
В классических исследованиях Rosen с соавт. (1975) выполняли моделированные секторальные резекции на удаленных операционных препаратах от пациентов, которым была выполнена мастэктомия по поводу предполагаемого монофокального рака молочной железы [18]. В результате исследования у значительного числа пациентов была обнаружена остаточная карцинома (in situ и инвазивная) в других квадрантах молочной железы. Вероятность обнаружения остаточной опухоли в других квадрантах молочной железы повышалась с увеличением размера первичной опухоли. У больных с опухолями менее 2 см остаточная опухоль в других квадрантах отмечалась в 26%, тогда как у пациентов с размером первичной опухоли более 2 см остаточную опухоль в других квадрантах наблюдали в 38%.
В нескольких недавно выполненных исследованиях были проанализированы предикторы остаточной опухоли, которые могут быть полезны в клинической практике в отношении повторных резекций. Молодой возраст, экстенсивный внутрипротоковый компонент (EIC) и трижды негативный фенотип (ER-, PR-, HER2-) были связаны с повышенным риском наличия остаточной опухоли после секторальной резекции при инвазивном раке молочной железы [19]. Другие исследования показали, что такие факторы, как размер опухоли, высокая степень гистологической злокачественности и степень вовлечения в опухолевый процесс краев резекции повышали риск выявления остаточной опухоли во время повторных резекций [20]. Факторами, повышающими вероятность выявления остаточной опухоли после секторальной резекции при DCIS, являлись наличие комедонекроза, мультифокальность, ширина края резекции и размер первичной опухоли [21].
Ограничения патоморфологической оценки краев резекции
Существуют практические ограничения патоморфологической оценки краев резекции, которые должны быть оценены при обсуждении «оптимального» хирургического края после секторальной резекции и при принятии тех или иных клинических решений. В настоящее время нет стандартизированного подхода к патоморфологической оценке хирургических краев резекции [22]. Важно понимать, что все технические методы оценки основаны на выборочном исследовании краев резекции [6], а патологи, как правило, не подвергают микроскопическому исследованию препараты ткани из всех краев резекции [22]. Обработка препаратов ткани, их исследование и техника оценки краев также влияет на результаты исследования [23]. Таким образом, соблюдение строгих клинических алгоритмов, основанных исключительно на измерении ширины краев резекции, не кажется клинически оправданным. Также представляется важным разработка единого стандарта патоморфологической обработки препаратов операционного материала и его анализа, что в конечном итоге приведет к более четкому определению взаимосвязи между краями резекции и отдаленными результатами.
Роль адъювантной терапии в снижении риска местных рецидивов после органосохраняющих операций
В нескольких сообщениях было показано снижение частоты местных рецидивов после органосохраняющего лечения в течение продолжительного времени, что, вероятно, связано с достижениями адъювантной терапии рака молочной железы [24]. Caioglu (2005) продемонстрировал снижение частоты местных рецидивов на протяжении длительного времени, что было связано как с высокой частотой негативных краев резекции, так и с применением адъювантной гормоно- и химиотерапии (р=0.001) [24]. В «старых» исследованиях была также показана связь между адъювантной гормонотерапией, химиотерапией и снижением частоты местных рецидивов у пациентов, перенесших органосохраняющее лечение [25, 26]. Среди пациентов с HER2-позитивными опухолями адъювантное применение трастузумаба в комбинации с химиотерапией было связано со снижением частоты местно-регионарных рецидивов [27].
Дополнительное облучение ложа опухоли (oost) также играет определенную роль в оптимизации локального контроля после органосохраняющего лечения. В исследовании EORTC 22881-10882 [28] было продемонстрировано снижение частоты местных рецидивов у пациентов, которые получили дополнительное облучение ложа опухоли после адъювантной лучевой терапии всей молочной железы (6,2%) по сравнению с больными, получившими только облучение всей молочной железы (10,2%).
Влияние биологических особенностей опухоли на частоту местных рецидивов
Хотя наличие опухоли в окрашенных краях резекции явно связано с высокой частотой местных рецидивов, как индивидуальные характеристики пациента, так и биологические особенности опухоли также связаны с повышением частоты местных рецидивов у пациентов, подвергавшихся органосохраняющему лечению. Индивидуальные характеристики пациента лежат в основе биологии опухоли, и степень их влияния на отдаленные результаты не уменьшается благодаря широким хирургическим краям резекции [4].
Молодой возраст пациента, экстенсивный внутрипротоковый компонент (EIC), базальный фенотип, HER2-позитивные опухоли, опухоли высокой степени гистологической злокачественности и лимфоваскулярная инвазия связаны с более высоким риском рецидива у пациентов, перенесших органосохраняющее лечение [29]. В недавних исследованиях были выявлены профили генной экспрессии, которые связаны с повышенным риском местно-регионарного рецидива рака молочной железы у пациентов, перенесших органосохраняющее лечение по поводу эстроген-рецептор-положительного инвазивного рака молочной железы [30]. Биологические характеристики, такие как степень гистологической злокачественности опухоли, размер и наличие комедонекроза являются важными при прогнозировании рецидивов у больных дуктальной карциномой in situ (DCIS) [31].
Последние достижения в области геномного секвенирования опухолей молочной железы у человека позволили выделить четыре биологические подтипа рака молочной железы, вызванных различными генетическими и эпигенетическими нарушениями [32]. Эти исследования демонстрируют возможность влияния на приемлемые критерии хирургических краев для каждого из этих подтипов.
Следовательно, и другие признаки (помимо измерения хирургических краев резекции) являются важными факторами риска рецидива, свидетельствуя о необходимости учета биологии опухоли и выбора адекватного системного лечения в оптимизации ОСЛ рака молочной железы.
Выводы
Согласен Данный веб-сайт содержит информацию для специалистов в области медицины. В соответствии с действующим законодательством доступ к такой информации может быть предоставлен только медицинским и фармацевтическим работникам. Нажимая «Согласен», вы подтверждаете, что являетесь медицинским или фармацевтическим работником и берете на себя ответственность за последствия, вызванные возможным нарушением указанного ограничения. Информация на данном сайте не должна использоваться пациентами для самостоятельной диагностики и лечения и не может быть заменой очной консультации врача.
Сайт использует файлы cookies для более комфортной работы пользователя. Продолжая просмотр страниц сайта, вы соглашаетесь с использованием файлов cookies, а также с обработкой ваших персональных данных в соответствии с Политикой конфиденциальности.