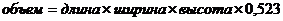Края резекции негативные что значит
Операция по удалению меланомы
Меланома – одна из самых опасных злокачественных опухолей. Она характеризуется агрессивным ростом и ранним метастазированием. Тем не менее, если «злокачественная родинка» вовремя диагностирована, ее можно удалить и вылечить человека. На поздних стадиях проводят паллиативные хирургические вмешательства, которые помогают улучшить состояние пациента, справиться с симптомами.
Широкое иссечение
Если по результатам биопсии диагностирована меланома, она должна быть полностью удалена. Хирург иссекает опухоль и некоторое количество здоровой ткани вокруг нее, под ней. Нормальные ткани захватывают для того, чтобы полностью удалить все опухолевые клетки.
После хирургического удаления меланому кожи отправляют для анализа в лабораторию. Важно проверить край резекции – участок ткани, который находится в месте разреза. Если здесь обнаружена только здоровая ткань, то край резекции негативный, это означает, что опухоль удалена полностью. Если в крае резекции обнаружены злокачественные клетки, то его называют позитивным. Это говорит о том, что опухолевая ткань, вероятно, удалена не полностью.
Чем больше здоровой ткани хирург захватил во время операции, тем выше вероятность того, что край резекции окажется негативным. Но в некоторых местах, например, на лице, важен косметический эффект. В таких случаях нужно искать золотую середину: постараться удалить как можно меньше окружающих здоровых тканей, но так, чтобы иссечь меланому полностью и не оставить опухолевых клеток в коже. После операции врач может назначить курс адъювантной химиотерапии. В некоторых случаях, если меланома находится на руке или на ноге, проводят ампутацию. Можно ли выполнить лазерное удаление меланомы? Лазерную хирургию широко применяют для удаления родинок, но при меланоме она зачастую не дает каких-либо преимуществ. Меланома – потенциально смертельное заболевание, это хирургическая патология, и в большинстве случаев ее нужно иссекать скальпелем. Чаще всего операцию проводят под местной анестезией. Одно из возможных последствий удаления меланомы лазером состоит в том, что может просто не остаться материала для биопсии, вся ткань опухоли будет уничтожена лазером. Лазерную хирургию иногда применяют на ранних стадиях опухоли, как правило, у пожилых людей.
Иссечение лимфатических узлов
После того как подтвержден диагноз меланомы, нужно проверить близлежащие к опухоли (их называют регионарными) лимфатические узлы – возможно, опухолевые клетки успели в них распространиться. Проводят компьютерную томографию, МРТ, ПЭТ-сканирование, тонкоигольную биопсию лимфоузлов. Если они тоже поражены, их иссекают.
Если по данным обследования регионарные лимфоузлы не поражены, можно провести сентинель-биопсию, или биопсию сигнального лимфатического узла. В область меланомы вводят радиофармпрепарат или флуоресцентный краситель.
Он проникает в лимфатические сосуды и распространяется по ним в лимфоузлы. Лимфатический узел, в который краситель попадает в первую очередь, называется сигнальным. Его удаляют и проводят биопсию.
Если в нем обнаруживают злокачественные клетки, то они, скорее всего, успели распространиться и в другие регионарные лимфоузлы. Сентинель-биопсия особенно полезна в случаях, когда меланома толще 1 мм.
В настоящее время неизвестно, можно ли вылечить пациента, удалив пораженные меланомой лимфоузлы. По крайней мере, это помогает продлить жизнь, уменьшить боль и другие симптомы.
Паллиативная хирургия при меланоме с метастазами
На ранней стадии возможно полное удаление меланомы. Даже если поражены регионарные лимфатические узлы, все еще остаются шансы на ремиссию. Если же обнаружены отдаленные метастазы, лечение может носить лишь паллиативный характер. Оно направлено на облегчение симптомов и продление жизни, но не на излечение.
Есть ли шанс вылечить больного, если у него только 1–2 метастаза, которые можно удалить хирургически? Если во время компьютерной томографии или МРТ обнаружен всего один метастаз, скорее всего, есть и другие, просто они очень малы, и их не удалось выявить. Шансы на ремиссию очень малы.
Тем не менее, хирургическое лечение все еще может помочь. Хирург может удалить некоторые метастазы, чтобы улучшить работу пораженных органов, устранить симптомы, увеличить продолжительность жизни больного.
На поздних стадиях на первый план выходят другие, нехирургические, методы лечения. Например, выживаемость помогают сильно увеличить иммунопрепараты из группы ингибиторов контрольных точек.
Последствия удаления меланомы
Возможные последствия хирургических вмешательств у пациентов с меланомой:
Цена удаления меланомы в Москве
Стоимость зависит от многих факторов: объема операции, исследований, которые могут потребоваться пациенту, ценовой политики клиники, опыта, квалификации и статуса хирурга, дополнительных методов лечения до и после операции.
Мы сотрудничаем с лучшими онкологическими центрами в Москве, в которых выполняются операции по удалению меланом на спине, лице и других частях тела. Мы порекомендуем хорошую клинику, в которой можно получить лечение при меланоме 4 стадии:
Края резекции негативные что значит
Рак молочной железы (РМЖ) в настоящее время занимает лидирующее место среди заболеваний женского населения планеты, особенно в возрастной группе старше 50 лет. Так, из 10 млн выявляемых в мире онкологических заболеваний РМЖ составляет > 10%, а за последнее десятилетие данная патология превзошла по частоте встречаемости рак шейки матки. Консервативная хирургия по сохранению груди с последующим облучением всей груди является стандартным вариантом лечения рака молочной железы (РМЖ) на ранней стадии на протяжении уже более 25 лет. Со временем частота местных рецидивов (в сроки до 10 лет) неуклонно снижалась и в настоящее время составляет 2 см [8, c. 990].
Также имеются другие факторы, кроме края резекции, которые влияют на частоту рецидивов. В метаанализе, включившем 7174 пациента, получавших органосохранную хирургию и ЛТ, относительный риск (ОР) развития местного рецидива у пациентов с опухолями, экспрессирующими гормональные рецепторы или HER2, составил 0,49 (95%-ный доверительный интервал [ДИ] 0,33–0,73) по сравнению с пациентами с тройным негативным раком (OP=0,33) [9, c. 840]. Влияние биологии опухоли на местный рецидив настолько глубокое, что статистически значимые различия в частоте наблюдаются среди опухолей размером 1 см и менее в зависимости от рецептора эстрогена (РЭ), рецептора прогестерона (РП) и статуса HER2 [10, c. 715]. Даже в подгруппе пациентов с отрицательными лимфоузлами, но с положительными РП и отрицательным HER2 показаны химиотерапия и тамоксифен – Mamounas и соавт. [11, c. 1682].
Другим фактором, существенно влияющим на частоту локального рецидива, является широкое применение адъювантной системной терапии. В одном метаанализе было показано, что тамоксифен в течение 5 лет уменьшил ОР рецидива до 0,47 по сравнению с плацебо (ОР=0,63) [12, c. 2091]. Достижения таргетной терапии также улучшили результаты выживаемости. Например, применение ингибиторов ароматазы или продолжительной гормональной терапии снизило ОР локального рецидива с 0,83 до 0,50 по сравнению с только тамоксифеном [13, c. 22]. Добавление трастузумаба к химиотерапии снижает ОР локального рецидива до 0,47 по сравнению с одной только химиотерапией, что приводит к снижению 3-летней частоты локального рецидива с 7% до 1% (р=0,01) [14, c. 1988]. В крупном анализе (n=86 598) пациентов, участвовавших в 53 рандомизированных исследованиях за период с 1990 по 2011 гг., доля локального рецидива в общем числе уменьшилась с 30% до 15% (p 2 см и клиническая болезнь N2 или N3 были статистически значимыми предикторами локального рецидива после органосохранного лечения РМЖ [30, c. 2303].
Все предостережения, касающиеся отсутствия стандартного подхода к патологической оценке полей при инвазивном раке, применимы к экстенсивным внутрипротоковым карциномам, а данные рандомизированных исследований уровня I о влиянии увеличения ширины полей на локальный рецидив отсутствуют. Существует несколько причин, по которым оптимальная ширина полей для этого типа может отличаться от инвазивного рака. Было продемонстрировано, что экстенсивная внутрипротоковая карцинома развивается в протоках прерывисто, что способствует возникновению остаточной опухоли. Поэтому ретроспективные исследования показали, что отрицательный край резекции ≥ 1 см и ЛТ снижают частоту локального рецидива. Это служило основой решения SSO, ASTRO и ASCO о разработке междисциплинарного, основанного на фактических данных консенсусного руководства для этих типов рака в 2015 г. Это руководство опирается на большой метаанализ, который включал 7 883 пациента в 20 исследованиях и 865 случаев локального рецидива. Медиана наблюдения составила 78,3 месяца, а частота локального рецидива – 8,3% [31, c. 3811]. Из-за неоднородности исследований был проведен как частотный, так и байесовский сетевой анализ, который подтвердил, что отрицательные поля по сравнению с положительными полями уменьшили риск локального рецидива примерно на 50%.
Заключение. Таким образом, рак молочной железы остается актуальной проблемой в онкологии. Несмотря на имеющиеся достижения, результаты еще остаются не вполне удовлетворительными. На результаты лечения влияют многие факторы, такие как биологические особенности опухоли, стадия опухолевого процесса, гормональный статус, возраст, гистологическая структура опухоли, выбор метода лечения и др. В последнее время мастэктомию упорно вытесняют органосохранные операции. Такой консервативный подход с использованием лучевой и гормонотерапии с учетом гормонального статуса позволил достичь хороших результатов в лечении. Однако до сих пор нет единого мнения, каковы должны быть величины ширины размеров края резекции при ранних стадиях рака молочной железы. Обзор литературных данных показал, что, к сожалению, количество повторных иссечений еще наблюдается, несмотря на четкую маркировку операционного поля. Диапазон дискутируемой разными авторами ширины резекции широк и колеблется от 1 мм до 10 мм. Однако метаанализы многочисленных исследований показали, что отрицательным край должен считаться при ширине 2 мм и менее.
Радикальные операции при раке
Радикальными называют операции, во время которых полностью удаляют злокачественную опухоль. После этого наступает ремиссия: по результатам контрольных обследований в организме пациента больше не обнаруживаются опухолевые очаги.
Радикальные операции обычно возможны на ранних стадиях рака — I и II. На III стадии, когда опухоль вторглась в окружающие ткани и/или распространилась в регионарные лимфатические узлы, в ряде случаев её всё ещё возможно удалить. При IV стадии рака с метастазами радикальное хирургическое лечение, как правило, невозможно. Иногда встречаются случаи, когда в организме больного есть лишь единичные метастатические очаги в одном органе, и их можно удалить, так же, как первичную опухоль. Но такие случаи, к сожалению, очень редки.
В международной клинике Медика24 выполняются практически все виды хирургических вмешательств при онкологических заболеваниях любой сложности. У нас работают ведущие хирурги-онкологи, торакальные хирурги, нейрохирурги и другие врачи-специалисты. Вмешательства выполняются в операционных, оснащенных современным оборудованием. При необходимости наши врачи дополняют радикальную операцию другими видами лечения, например, химиотерапией, таргетной терапией. Современные реабилитационные программы помогают нашим пациентам в кратчайшие сроки восстанавливаться после хирургических вмешательств и возвращаться к полноценной жизни.
Наши врачи вам помогут
Виды радикальных операций в онкологии
Типичный объем радикальной операции при раке — когда удаляют часть органа, пораженную злокачественной опухолью, или весь орган целиком, а также некоторое количество регионарных лимфатических узлов. В некоторых случаях, когда есть подозрение, что рак успел сильно распространиться в организме, приходится удалять большее число лимфатических узлов. Такая радикальная операция называется расширенной.
Основные виды радикальных операций:
Принципы выполнения радикальных операций при раке
Важная особенность операций в онкологии в том, что хирург должен принять некоторые специальные меры, чтобы не оставить в организме пациента раковых клеток и не допустить их распространения. Необходимо придерживаться принципов абластики и антибластики.
Принципы абластики и антибластики:
| Абластика | Антибластика |
| Хирург должен тщательно отграничить операционную рану от окружающих тканей. | Меры, направленные на укрепление устойчивости, защитных сил организма. |
| Нужно применять электроскальпели и лазерные скальпели: они сразу прижигают рану и предотвращают распространение опухолевых клеток. | Сочетание хирургического лечения с химиотерапией, лучевой терапией. |
| Все тупферы и марлевые шарики можно использовать только один раз, а затем их нужно сразу выбрасывать. | В некоторых случаях противоопухолевые препараты и облучение применяют прямо во время операции. |
| Каждые 30–40 минут меняют хирургические перчатки, инструменты. | Хирурги принимают некоторые специальные меры, чтобы не дать опухолевым клеткам прикрепиться к нормальным тканям. |
| Все кровеносные сосуды, подходящие к пораженному органу, перевязывают до того, как их пересечь. | |
| Пораженный орган удаляют с захватом некоторого количества окружающих тканей единым блоком с лимфатическими узлами и клетчаткой. |
Позаботьтесь о себе, запишитесь на консультацию сейчас
Методика морфологического исследования препарата после радикальной простатэктомии
Набебина Т.И., Дубровский А.Ч., Ролевич А.И., Поляков С.Л.
В последние годы отмечается значительный рост выявления рака предстательной железы (РПЖ) на территории Республики Беларусь. По всей видимости, этот рост отражает наметившуюся тенденцию в странах СНГ к раннему выявлению РПЖ вследствие участившегося определения уровня простат-специфического антигена (ПСА) в крови у бессимптомных пациентов [1]. Увеличение частоты выявления локализованного и местно-распространенного РПЖ привело к увеличению частоты выполнения радикальной простатэктомии (РП) в последние 3-5 лет в ГУ НИИ ОМР (рис. 1).
Одним из самых важных вопросов, стоящих перед патоморфологами и урологами, является грамотное определение прогноза после операции для каждого конкретного больного. Результаты патоморфологического исследования препарата после РП являются наиболее ценной информацией для ответа на этот вопрос. Так, по данным Stamey с соавт. [2] рецидив РПЖ после РП может быть предсказан с высокой степенью точности на основании результатов патоморфологического исследования. В настоящей работе, в основу которой положены последние рекомендации рабочей группы Европейского Общества Уропатологов [3], дается обзор методики морфологического исследования препарата после РП.
СТРОЕНИЕ И ФУНКЦИЯ ПРЕДСТАТЕЛЬНОЙ ЖЕЛЕЗЫ
Роль и функция предстательной железы (ПЖ) в организме мужчины, по-видимому, до конца не выяснены. Секрет железы составляет около 20% объема семенной жидкости, в нем содержатся вещества, способствующие подвижности сперматозоидов, но не являющиеся жизненно необходимыми для оплодотворения. ПЖ охватывает проксимальную часть мочеиспускательного канала и имеет форму усеченного конуса, обращенного широкой частью к мочевому пузырю. Выделяют переднюю, заднюю и боковые поверхности, снизу – верхушку и сверху – основание. Проходящая по задней поверхности бороздка делит ПЖ на две доли.
ПЖ состоит из тубуло-альвеолярных желез, сгруппированных в дольки и окружающей железы стромы. Выводные протоки желез соединяются в более крупные, которые открываются в простатическую уретру. ПЖ окружена плотной капсулой, состоящей из коллагена, эластина и большого количества гладкой мускулатуры. ПЖ граничит с прямой кишкой сзади, мочевым пузырем сверху и лонной костью спереди, мышцами тазового дна латерально и произвольным поперечно-полосатым сфинктером снизу. Кзади и латеральнее ПЖ проходят т.н. сосудисто-нервные пучки. В их составе идут тонкие ветви внутренней подвздошной артерии, кровоснабжающие семенные пузырьки и простату. Эти сосуды сопровождают вегетативные нервные волокна (т. н. кавернозные нервы), которые идут от тазового сплетения и иннервируют ПЖ и кавернозные тела полового члена. ПЖ окружена венозным Санториниевым сплетением.
Зональная анатомия ПЖ. ПЖ состоит из пяти зон: центральной, периферической, переходной, периуретральной и передней фибромускулярной стромы (рис. 2). РПЖ развивается с различной частотой в каждой зоне, и эта частота не пропорциональна массе железистой ткани в ней. Центральная и периферическая зоны – наиболее крупные участки ПЖ – вместе составляют около 95% железистой ткани предстательной железы. Центральная зона окружает семявыносящие протоки на их пути от основания ПЖ к семенному бугорку. Центральная зона занимает 15-20% объема железы, однако в ней возникают только 5-10% от всех РПЖ. Периферическая зона – пальпируемая через прямую кишку часть железы. Она окружает центральную зону, включает 70% железистой ткани, и в ней возникает около 70% аденокарцином ПЖ. Переходная зона – парные участки ПЖ, которые располагаются по бокам от простатической уретры на уровне семенного бугорка, занимают оставшиеся 5% железы. Самой частой патологией этой зоны является доброкачественная гиперплазия предстательной железы (ДГПЖ), которая может приводить к значительному увеличению этих зон, иногда превышающему по объему остальные участки ПЖ. В этой зоне РПЖ развиваются реже, чем ДГПЖ, частота его составляет около 20%. Периуретральные железы располагаются между простатической уретрой и проксимальным гладкомышечным сфинктером мочевого пузыря. Фибромускулярная строма занимает переднюю поверхность ПЖ и состоит преимущественно из мышечной ткани. Аденокарциномы в двух последних зонах не развиваются.
МЕТОДИКА ОБРАБОТКИ МАКРОПРЕПАРАТА ПОСЛЕ РП
Свежий (нефиксированный) препарат после РП рекомендуется взвешивать и измерять в трех измерениях (длина, ширина и толщина). Оценка веса макропрепарата после РП достаточно важна, особенно в сочетании с комментариями патоморфолога, относящимися к оценке полноты резекции предстательной железы. Из-за того, что ПЖ имеет неправильную форму и симметрична только относительно сагиттальной плоскости, линейные размеры препарата менее точны, воспроизводимы и ценны чем вес препарата [5, 6]. Объем препарата может быть приблизительно определен по формуле, используемой для округлых образований [7]:
Поскольку поверхность ПЖ покрывает фиброзно-мышечная ткань, не образующая отдельной обособленный гистологической границы между железой и экстрапростатической соединительной тканью, оценить радикальность операции может быть весьма сложно как хирургу, так и патоморфологу, что привело к разработке специальной методики оценки краев резекции ПЖ. Для последующего определения состояния краев резекции органа вся поверхность удаленной и нефиксированной ПЖ должна быть окрашена. Если этого не выполнить, то морфолог не сможет определить в микропрепарате является ли обнаружение роста опухоли по краю позитивным хирургическим краем или это артефакт нарезки. Также достоверно судить о наличии опухоли по краю резекции на основании осмотра поверхности макропрепарата также нельзя. Для этого может использоваться черная тушь, поскольку черные края резекции проще распознаются при микроскопическом исследовании. Другим вариантом окраски поверхности железы является применение двух разных цветов для каждой стороны препарата для облегчения последующей ориентации и распознавания правой и левой стороны [8]. Обычно используются зеленый и красный (или синий) цвета. После окраски поверхности препарат погружается в фиксирующий раствор, например раствор Боуэна или уксусную кислоту, после чего тушь фиксируется на поверхности ПЖ и не смывается при проводке [8].
Перед разрезанием ПЖ на фрагменты рекомендуется ее фиксировать в формалине, что обеспечивает получение более тонких срезов. Для снижения времени фиксации и равномерной пенетрации формалина в железу, в препарат инъекционно вводится нейтральный 10% раствор формалина с использованием тонкой внутрикожной иглы. Обоснованием этой методики является то, что при обычном погружении железы в раствор формалина, проникновение его в толщу органа слишком медленное и неравномерное, кроме того, коагулированные формалином белки в ткани периферической зоны ПЖ затрудняют дальнейшую пенетрацию раствора [9].
После фиксации производится нарезка препарата на отдельные части (рис. 3). Сначала из макропрепарата удаляются семенные пузырьки. Семенные пузырьки исследуются после их секции через место вхождения в ПЖ (основание семенного пузырька) [10]. Практически все случаи опухолевой инвазии семенных пузырьков первоначально вовлекают основание семенного пузырька. Опухоль врастает в семенные пузырьки либо прямо через семяизвергающий проток либо вторично вследствие распространения опухоли за пределы ПЖ в перипростатические соединительные ткани и затем в просвет семенного пузырька [10].
После удаления семенных пузырьков двумя поперечными разрезами на расстоянии 4 мм от дистального и проксимального краев ПЖ от препарата отрезаются апикальная и базальная части железы. Эти участки затем нарезаются на части в парасагиттальном направлении перпендикулярно окрашенной поверхности с интервалом 4 мм как показано на рис. 3.
Оставшийся после удаления апикальной и базальной частей ПЖ макропрепарат последовательно нарезается с 4 мм интервалами перпендикулярно длинной (апико-базальной) оси ПЖ. Эти срезы ПЖ рекомендуется обозначать последовательными заглавными буквами алфавита, всегда начиная с наиболее апикального участка и заканчивая базальным. Такие срезы через всю ПЖ после заливки в парафин для микроскопического исследования рекомендуется нарезать таким же образом, т.е. перпендикулярно длинной (апико-базальной) оси на всю толщу ПЖ. Альтернативой такому приготовлению микропрепаратов может быть разделение 4-мм слоев на квадранты, которые нумеруются арабскими цифрами. При таком методе вся предстательная железа доступна для гистологического исследования [11]. Если для окраски поверхности ПЖ используется тушь, то для пометки правой стороны используется надрез скальпелем каждого среза по переднее-латеральной поверхности препарата справа. После такой нарезки препарата фрагменты можно дополнительно фиксировать в формалине в течение 24 ч.
Обоснованием необходимости полной заливки ПЖ в парафин является то, что идентификация локализации и распространения опухоли при макроскопическом исследовании порезанной ПЖ не всегда возможна, особенно при РПЖ, выявленном случайно или в ходе скрининга. Недавно опубликованное исследование Desai с соавт. [12] демонстрирует, что по сравнению с обычной методикой приготовления микропрепарата, полная заливка и частая нарезка макропрепарата после РП увеличивает частоту выявления распространения опухоли за пределы ПЖ, и приводит к повышению безрецидивной выживаемости при каждой стадии РПЖ.
Получившиеся фрагменты ПЖ ступенчато дегидратируются в разведенных спиртах, осветляются в ксилоле, заливаются в парафин, нарезаются на слои толщиной 5 мкм, окрашиваются гематоксилин-эозином, после чего могут исследоваться гистологически (рис. 4). При этом должны использоваться формовочные кассеты и предметные стекла специальных размеров. Предметные и покровные стекла должны быть как минимум 76 мм в длину и 50 мм в ширину [11, 13].
Выбор между получением срезов всего препарата или исследования его квадрантов зависит от предпочтений патоморфолога, на которое влияют удобство и простота исследования больших срезов и технические проблемы получения и хранения препаратов нестандартного размера. Единственным существенным отличием в методике получении препаратов при использовании этих двух подходов является то, что требуется более толстая нарезка целой ПЖ. Кроме того, выполнение ИГХ требует обычно большего количества реагента и может выполняться только вручную [13].
МЕТОДИКА ИССЛЕДОВАНИЯ МАКРОПРЕПАРАТА ПОСЛЕ РП В СЛУЧАЕ pT0
Если при исследовании микропрепаратов патоморфолог не находит РПЖ, рекомендуется следующее: если ПЖ не была залита в парафин полностью, то рекомендуется это выполнить; если ПЖ была полностью залита в парафин, для оценки локализации опухоли необходимо пересмотреть микропрепараты после биопсии. Необходимо перерезать участки препарата после РП в этой зоне после переворачивания блока.
Для обнаружения т.н. “минимального остаточного рака”, особенно у больных, получавших до операции неоадъювантную гормональную терапию можно выполнить иммуногистохимическое исследование с антителом против CAM 5,2 [14].
ЗАКЛЮЧЕНИЕ ПО ПРЕПАРАТУ ПРЕДСТАТЕЛЬНОЙ ЖЕЛЕЗЫ
Полное и четкое заключение патоморфолога по удаленному в ходе РП препарату ПЖ весьма важно для выработки оптимальной тактики лечения больного. Заключение должно содержать клинически значимую информацию, полученную на основании макро- и микроскопического исследований препарата после РП. Основное внимание должно уделяться оценке факторов прогноза, включенных Коллегией Американских Патологов (College of American Pathologists) в категории 1 и 2 (табл. 1) [6]. Эти факторы с доказанной прогностической значимостью и используемые в лечении больного, включают гистологический тип опухоли, степень дифференцировки, объем рака, степень местной распространенности и стадию РПЖ а также состояние краев резекции. Также могут использоваться и другие изученные биологические и клинические факторы, прогностическая значимость которых еще не подтверждена в крупных исследованиях.
Гистологический тип РПЖ. Гистологическая классификация РПЖ представленная в табл. 2 [15]. Более 95% от всего РПЖ имеют типичное строение ацинарной аденокарциномы. В последние годы были описаны несколько новых и необычных гистологических вариантов РПЖ. Эти варианты представляют собой спектр изменений, которые могут происходить в аденокарциноме и должны указываться в морфологическом заключении, если обнаруживаются в препарате. Кроме того, существует ряд опухолей ПЖ, например, переходно-клеточный, плоскоклеточный, базалоидный и аденокистозный раки, биологическое поведение и методы лечения которых существенно отличаются от типичного РПЖ, что делает точную диагностику типа опухоли крайне важной для определения тактики лечения больного.
Степень дифференцировки (степень злокачественности). Наиболее значимым предиктором прогрессирования РПЖ после РП является сумма Глисона, определенная в препарате после РП (табл. 3) [16–19]. Система Глисона является методикой выбора при определении степени злокачественности опухоли, использовать термины “высокодифференцированный”, “умереннодифференцированный” и “низкодифференцированный” для определения степени злокачественности РПЖ не рекомендуется [6]. Сумма Глисона состоит из двух слагаемых: первичного (наиболее распространенного) и вторичного (второй по распространенности) показателей Глисона (Gleason grade). Если в препарате не выявляется вторичный показатель Глисона, то для получения сумы Глисона первичный показатель Глисона удваивается. Первичный и вторичный показатели Глисона должны указываться в скобках после указания суммы Глисона (например: сумма Глисона 7 (3 + 4)). Для группировки суммы Глисона в категории с целью обобщения результатов лечения и т.д., рекомендуется следующая группировка (табл. 4): 2-5, 6, 7, 8-10, или 2-6, 7, 8-10.
Если в препарате после РП идентифицируется две или более отдельных опухоли, можно указывать суммы Глисона каждой опухоли либо должна быть указана сумма Глисона наиболее значительной опухоли. Например, если имеется большая опухоль в переходной зоне ПЖ с суммой Глисона 5 и отдельная меньшая опухоль в периферической зоне с суммой Глисона 7, то должны указываться обе суммы Глисона или по меньшей мере сумма Глисона последней опухоли, а не усредненное значение суммы Глисона.
Из-за большего количества опухоли в препарате после РП, доступной для исследования, (в отличие от биопсийного материала), часто возможна ситуация, когда в опухоли обнаруживается более двух показателей Глисона (Gleason grade), т.е. имеется третичный показатель Глисона. Поскольку оригинальная система Глисона учитывает только первичный и вторичный показатели Глисона, в подходе к оценке степени злокачественности при опухолях с третичным показателем Глисона имеются разногласия, несмотря на то, что наличие третичного показателя Глисона влияет на прогноз. Так, частота прогрессирования РПЖ с суммой Глисона 5-6 и третичным показателем 4 почти такая же, как и при опухолях с суммой Глисона 7. В свою очередь опухоли с суммой Глисона 7 и третичным показателем 5 ведут себя как опухоли с суммой Глисона 8. С другой стороны таких различий не наблюдается при РПЖ с суммой Глисона 8 и третичным показателем 5, по-видимому вследствие небольшого количества больных с такой патологией а также настолько неблагоприятного прогноза при РПЖ с суммой Глисона 8, что присутствие третичного показателя 5 существенно не может его ухудшить [20].
Другим дискутабельным вопросом при определении степени злокачественности является вопрос об определении суммы Глисона в опухолях, состоящих на 95% из одного типа по Глисону, в которых имеется только небольшое количество более низкодифференцированной опухоли. Например, опухоль ПЖ, содержащую > 95% опухолевой ткани с показателем Глисона 3 и