Левовращающие аминокислоты что такое
D-аминокислоты: не только в Зазеркалье
D-аминокислоты: не только в Зазеркалье
С какой стороны зеркального стекла? В последнее время стали открывать все больше примеров функций D-аминокислот не только в бактериях, но и в эукариотах. Так что, по-видимому, представление о том, что D-аминокислоты во вселенной белков, построенных из L-аминокислот, являются аутсайдерами, постепенно отходит в прошлое.
Автор
Редакторы
По до сих пор неизвестным причинам в состав белков живых организмов входят преимущественно L-энантиомеры (оптические изомеры) аминокислот, — за довольно редкими и разрозненными исключениями вроде пептидных веществ, образующихся в грибах и бактериях путём нерибосомного синтеза. (Зато сахара находятся преимущественно в D-форме.) Новое исследование выводит D-аминокислоты из «зазеркалья»: обнаружено, что некоторые бактерии — в частности, холерный вибрион и сенная палочка, — синтезируют D-формы аминокислот. Они используются бактериями как связующий компонент пептидогликанового слоя, а также регулируют работу ферментов, ответственных за армирование клеточных стенок.
Верно ли, что Оспод и Погг, не ограничиваясь обычным загрязнением беззащитной, пустынной планеты, решили, по пьяному делу, учинить на ней, самым бесстыдным и возмутительным образом, биологическую эволюцию, какой еще свет не видывал? Верно ли, что эти безобразники, лишенные всякого чувства приличия и нравственных тормозов, вылили на скалы безжизненной Земли шесть бочек заплесневелого желатинового клея и два ведра испорченной альбуминовой пасты, подсыпали туда забродившей рыбозы, пентозы и левуллозы и, словно им мало было всех этих гадостей, добавили три больших бидона с раствором прокисших аминокислот, а получившееся месиво взболтали угольной лопатой, скособоченной влево, и кочергой, скрученной в ту же сторону, в результате чего белки всех будущих земных существ стали ЛЕВОвращающими?!
Вступив из своей комнаты в загадочный мир зазеркалья, маленькая героиня Льюиса Кэррола — английская девочка Алиса — узнала, что эти два мира, на первый взгляд выглядящие столь похожими, на самом деле существенно отличаются. Алиса интуитивно чувствует, что даже молоко в мире-отражении совсем не такое, как тот вкусный и полезный напиток, которым она привыкла наслаждаться у себя в Англии: «Впрочем, не знаю, можно ли пить зазеркальное молоко? Не повредит ли оно тебе, Китти. » [1]. И правда: то ли Кэррол (то есть, конечно, Чарльз Лютвидж Доджсон) уже знал о стереохимических свойствах органических соединений, то ли предвосхитил это знание, — но так или иначе, подавляющее большинство биологических молекул может существовать в виде двух зеркальных отражений друг друга, не совмещаемых простым наложением. Девятнадцать из 20 природных аминокислот (кроме глицина) являются хиральными, — то есть, расположение заместителей вокруг центрального атома углерода (Cα) может дать две зеркально-симметричные молекулы, похожие друг на друга как перчатки с левой и правой руки. Пары таких молекул называются стереоизомерами (или оптическими изомерами, или энантиомерами), и по одной из классификаций обозначаются L- и D-аминокислотами (см. рисунок в заглавии).
Одной из самых интересных загадок зарождения жизни является преимущественное использование в качестве «строительных блоков» белков именно L-аминокислот, в то время как их D-аналоги долгое время считались чуть ли не биохимическим недоразумением, которым можно с чистой совестью пренебречь [2–4]. (Впрочем, определённые соображения на этот счет все же есть: см. эпиграф. — А. Ч.) Однако, время не стоит на месте: в журнале Science появилась статья, авторы которой бросают вызов этому устаревшему представлению и показывают, что D-аминокислоты играют важную роль в жизни бактерий, управляя их реакцией на различные пищевые стимулы [5].
Если вернуться к Алисе, то её сомнения насчет молока были отнюдь не беспочвенными: ведь пара «зеркальных» молекул, хотя во многих отношениях и идентична (например, молекулярная масса, углы и длины связей у них равны), может иметь разительно отличающиеся биологические характеристики. В частности, Алисе вряд ли удалось бы переварить молоко, белки которого состоят исключительно из D-аминокислот. Такое смещение «равновесия» в сторону L-аминокилот, безусловно, ставит вопрос: а играют ли D-аминокислоты какую-то роль в природе? Исследование Губерта Лэма (Hubert Lam) [5] — учёного из Гарварда и Института Ховарда Хьюза в США, — а также его коллег, показывает, что неизвестное — не значит «не существующее»: согласно их данным, D-аминокислоты управляют у бактерий таким важным процессом как «сборка» клеточной стенки.
Клеточная стенка является, по сути, «крепостной стеной» бактериальной клетки, защищая её от разнообразных неблагоприятных факторов окружающей среды. Состоит она главным образом из пептидогликана — эластичного полимера, в котором сахара и аминокислоты «сшиваются» между собой подобно сетке и охватывают бактериальную мембрану целиком. Одна из ролей D-аминокислот здесь — образовывать поперечные пептидные сшивки между длинными углеводными тяжами пептидогликанов; эти сшивки обогащены D-аланином и D-глутаминовой кислотой, роль которых предположительно заключается в противостоянии расщеплению клеточной стенки враждебными ферментами-гидролазами, «настроенными» только на L-аминокислоты.
Для успешного роста и процветания микроорганизмов пептидогликан должен обладать незаурядной пластичностью: ведь бактерии, оказавшись в богатой питательными веществами среде, немедленно начинают делиться, и клеточная стенка должна делиться вместе с ними, чтобы не оставить потомство без защиты. В период сомнений и тягостных раздумий стресса же пептидогликан должен, наоборот, становиться жёстче, чтобы максимально усилить защиту бактерии. Однако факторы, управляющие этими сложными превращениями при переходе от «довольства» к голоданию, практически не были известны.
Одним из объектов, с которым работала команда Лэма, является бактерия Vibrio cholerae, или холерный вибрион, являющийся возбудителем острой кишечной инфекции. Исследователи отметили, что состояние клеточной стенки бактерии меняется в зависимости от содержания в питательной среде определённых аминокислот. К удивлению учёных, D- (а не L-!) энантиомеры метионина и лейцина вызывали замедление синтеза пептидогликана и смену «режима» образования поперечных сшивок в клеточной стенке. Роль этих аминокислот в перестройке клеточной стенки была дополнительно подтверждена открытием у холерного вибриона нового фермента, синтезирующего эти D-аминокислоты. Что интересно, в аналогичный процесс у грамположительной бактерии Bacillus subtilis (сенной палочки) оказались также вовлечены две D-аминокислоты, но другие: D-тирозин и D-фенилаланин.
Как именно под действием D-аминокислот происходит перестройка клеточной стенки, пока в точности не ясно. По-видимому, увеличение их содержания как-то влияет на частоту и/или длину сшивок пептидогликана и, следовательно, на прочность и гибкость. Нельзя исключить также возможность, что D-аминокислоты регулируют активность периплазматических ферментов, синтезирующих и перестраивающих клеточную стенку.
Постепенно накапливаются и другие примеры функциональной важности D-аминокислот. У некоторых видов бацилл образование вегетативных клеток из спор регулируется именно относительным содержанием в среде L- и D-аминокислот, которые, соответственно, индуцируют или замедляют проращивание посредством взаимодействия со специальными рецепторами на поверхности спор [6]. На поверхности капсулы B. anthracis — возбудителя сибирской язвы — находятся полимеры с высоким содержанием D-глутаминовой кислоты, что, по-видимому, защищает бактерию от действия протеаз [7]. D-аминокислоты во множестве содержатся в природных антибиотиках, иммуносупрессорных лекарствах и противоопухолевых веществах [8].
Хотя еще совсем недавно D-аминокислоты считались исключительно «артефактом» бактерий и грибов, появляются данные и о роли этих веществ у эукариот. Эндогенный D-серин выполняет в мозгу млекопитающих функцию нейротрансмиттера [9]. D-аспарагиновая кислота найдена в нейроэндокринных тканях млекопитающих, где она модулирует гормональную секрецию [10].
Возвращаясь напоследок снова к Алисе — точнее, к её создателю Чарлзу Доджсону, — можно высказать предположение, что он (Доджсон) всё-таки знал о вопросах, возникающих в стереохимии, поскольку Луи Пастер (знаменитый химик и микробиолог) был его современником. Пастер к тому моменту уже опубликовал несколько работ по хиральным свойствам винной кислоты, найденной на дне бутылки во многих восхитительных яствах по эту сторону зеркального стекла, — например, в винах и некоторых фруктах и растениях.
Открытия новых функций D-аминокислот, несомненно, продолжатся, и несправедливой дискриминации этих неплохих, в сущности, соединений недолго ещё осталось жить на Земле 🙂
По материалам рубрики «Перспектива» Science [11].
За доминирование левовращающих аминокислот в земных организмах, возможно, отвечает круговая поляризация
Автор: Александр Березин
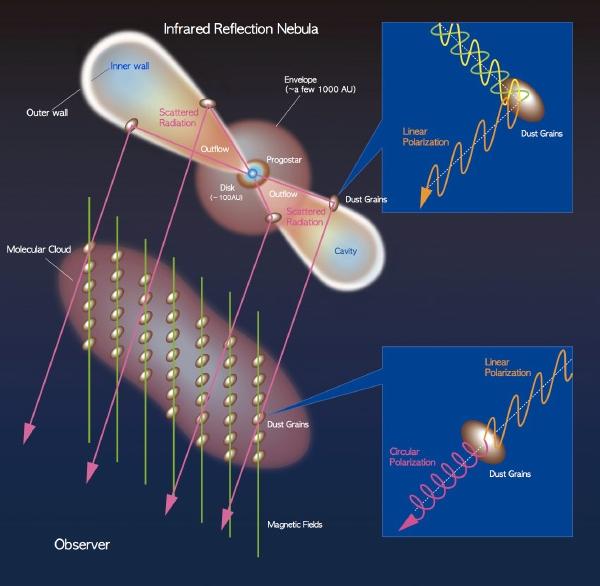
Наблюдения эмиссионной туманности NGC 6334 ( Кошачья лапа ) показали, что для её областей активного звездообразования свойственна круговая поляризация излучения, утверждают учёные под руководством Чун Ми Кхвона ( Jungmi Kwon ) из Национальной астрономической обсерватории Японии. Эмиссионная туманность Кошачья лапа расположена в созвездии Скорпиона в 5 500 световых лет от Земли; по свойствам она, предположительно, похожа на ту область, где формировалась Солнечная система.
Степень круговой поляризации в этом регионе была равна 22% для ближнего ИК-излучения. В качестве рабочей гипотез ы её появления исследователи предполагают рассеивание инфракрасного излучения с последующим дихроическим избирательным поглощением света различных длин волн мощным газопылевым облаком, характерным для эмиссионной туманности и содержащим упорядоченные пылевые частицы. Они-то и сыграли роль дихроического поляризационного фильтра.
Из-за этого дальнейший синтез лежащих в фундаменте жизни сложных органических веществ из смеси, получавшейся в эксперименте Миллера — Юри, затруднён. И именно поэтому эксперимент часто критиковался, а возможность возникновения живых существ известных нам типов на основе таких процессов отрицалась. Если же, как считает группа Чун Ми Кхвона, преобладание левовращающих аминокислот обусловлено процессами поляризации излучения ещё в областях звездообразования, то проблема дальнейшего синтеза органических веществ выглядит значительно проще, чем казалось.
Эволюция лекарственных препаратов сквозь призму креационизма
В третьем тысячелетии к новым лекарственным препаратам предъявляются как никогда раньше жесткие требования эффективности и безопасности. Усовершенствование технологий и научных возможностей в фармацевтической индустрии позволило разработать лекарства для лечения хронических и дегенеративных заболеваний. Однако это потребовало проведения продолжительных клинических исследований, поскольку при хронических заболеваниях для достижения результата необходимо принимать препараты длительно, при этом они должны тщательнее изучаться на предмет наличия отложенных побочных эффектов. В то же время терапевтический эффект таких препаратов менее заметен, поскольку лечение хронических заболеваний предполагает купирование интенсивности проявлений заболевания, а не их полное разрешение.
В среднем на создание новой молекулы (разработка, доклиническая фаза, последующие клинические исследования и получение одобрения регуляторными органами) требуется 11,8 года. Для получения репрезентативных статистических данных в исследования вовлекается все больше пациентов, поэтому средняя стоимость научно-исследовательских опытно-конструкторских разработок (НИОКР) новых препаратов неуклонно растет: в 1976 г. она составляла 137 млн долларов США за препарат, в 2000 г. – 802 млн, а в конце 2014 г. – уже 2,56 млрд. Эта усредненная сумма отражает расходы на разработку не только молекул, одобренных к применению и выведенных на фармацевтический рынок (21,5% от общего числа), но и неуспешных молекул, эффективность которых не была доказана (78,5%) [1].
На сегодняшний день почти половина расходов на исследования и разработку новых препаратов покрывается за счет государственных или некоммерческих фондов. Эта цифра продолжает расти, так как правительства прилагают усилия по устранению дефицита на рынке новых лекарств. Получается, что налогоплательщики не только финансируют большую долю индустрии исследований и разработки препаратов, но и платят второй раз, покупая препараты по высоким ценам.
Возможно, расходы коммерческих кампаний преувеличены. Опыт разработчиков медикаментов для некоммерческого использования свидетельствует о том, что общая сумма затрат на исследования составляет от 10–40 млн (доработка и усовершенствование старой молекулы) до 100–150 млн долларов США (НИОКР новой молекулы) с учетом риска их возможной неэффективности [2]. Таким образом, НИОКР по усовершенствованию старых, проверенных временем молекул на порядок выгоднее новых. Кроме того, в долгосрочной перспективе от новых молекул можно ожидать непредсказуемых отсроченных побочных эффектов, как позитивных (например, у силденафила), так и негативных (у рофекоксиба, талидомида и т.д.).
В этой связи значительным научно-исследовательским потенциалом обладают пространственные изомеры старых лекарств – соединения, имеющие одинаковую молекулярную формулу, одинаковый порядок связывания атомов углерода в молекулах, но отличающиеся друг от друга расположением атомов в пространстве. Пространственные изомеры называют также стереоизомерами (греч. stereos – пространственный) и подразделяют на конформационные и конфигурационные.
Конформационная (поворотная) изомерия обусловлена вращением атомов или атомных групп вокруг одной или нескольких простых стереосвязей. В результате вращения вокруг углеродных (чаще всего) связей молекулы могут иметь разные пространственные формы, которые называют конформациями. Например, молекула этана вследствие вращения вокруг углерод-углеродной связи может принимать бесконечное множество конформаций, каждая из которых характеризуется определенным значением потенциальной энергии. Две крайние конформации называют заслоненной и заторможенной. Энергетическая неравноценность конформаций объясняется существованием в молекуле так называемого торсионного напряжения (напряжения Питцера), которое обусловлено взаимодействием (отталкиванием) электронных облаков противостоящих связей. В заслоненной конформации противостоящие связи максимально сближены, поэтому между ними возникает наибольшее взаимодействие. В отличие от конфигурационных изомеров конформеры превращаются друг в друга без разрыва химических связей и не поддаются разделению. Они обнаруживаются только физико-химическими методами. В околонаучной литературе имеются многочисленные спекуляции разного рода экстрасенсов, приверженцев биорезонансных методов терапии (метод Фолля) и производителей физических псевдонаучных приборов, которые якобы заряжают различные вещества, изменяя конформационную структуру за счет воздействия торсионных полей. Исследования в этой области пока не имеют убедительной доказательной базы терапевтической эффективности, но в будущем по мере развития нанотехнологий возможно появление реальных достижений по усовершенствованию конформационной структуры лекарственных веществ.
На современном этапе развития химических технологий наиболее перспективной НИОКР является исследование фармакологических свойств конфигурационных пространственных изомеров лекарственных веществ, к которым относится оптическая и геометрическая изомерия.
Геометрические изомеры имеют разные физические (температуру плавления и кипения, растворимость и т.д.) и химические свойства, а также спектральные характеристики (рис. 1). Эти отличия позволяют легко установить их конфигурацию с помощью физических и химических методов. По сути, геометрические изомеры – это разные фармакологические вещества и НИОКР каждого нового геометрического изомера может иметь непредсказуемый результат в отношении как безопасности, так и эффективности.
В 1815 г. Ж.Б. Био (J.B. Biot) открыл существование оптической активности для органических соединений [3]. Было установлено, что некоторые органические соединения способны вращать плоскость поляризации света. Они получили название оптически активных. Обязательным условием оптической активности является хиральность (греч. cheir – рука) – свойство молекул не совмещаться со своим зеркальным изображением, при этом молекулы называют хиральными энантиомерами. Энантиомеры имеют противоположный угол хиральности, то есть противоположную конфигурацию. Один из энантиомеров вращает плоскость поляризации света вправо, а другой – на точно такой же угол влево. Наглядным примером могут служить левая и правая руки, которые зеркально отражают друг друга, вместе с тем их нельзя совместить (рис. 2). Молекулы, которые совместимы со своим зеркальным изображением, называют ахиральными.
Энантиомеры очень похожи друг на друга, но тем не менее не тождественны. Они имеют одинаковый состав и последовательность связывания атомов в молекуле, но отличаются друг от друга относительным расположением в пространстве, то есть конфигурацией. В том, что эти молекулы разные, легко убедиться при попытке наложения их моделей друг на друга.
Энантиомер именуется по направлению, в котором его раствор вращает плоскость поляризации света. Если вращение происходит по часовой стрелке, то такой энантиомер называется правовращающим (+). Его оптический антипод именуется левовращающим (-). Данная номенклатура появилась до того, как были открыты методы установления абсолютной конфигурации энантиомеров. Она является эмпирической и напрямую не связана с расположением атомов в пространстве.
D/L-номенклатура была введена для описания относительной конфигурации моносахаридов. Она основана на конфигурации глицеринового альдегида, существующего в виде двух энантиомеров, из которых путем последовательных реакций наращивания углеродной цепи можно получить производные моносахариды (тетрозы, пентозы, гексозы и т.д.). Поскольку в процессе наращивания углеродной цепи стереоцентр глицеринового альдегида не затрагивается, все производные сахара, по Фишеру, получают то же обозначение относительной конфигурации, что и исходный глицериновый альдегид. Современные методы установления структуры соединений позволяют характеризовать конфигурацию моносахаридов, не сравнивая их с глицериновым альдегидом. Однако D/L-номенклатура традиционно сохраняется в названиях сахаров и аминокислот. Обозначения D или L связаны с расположением функциональной группы (гидроксильной для сахаров и аминогруппы для аминокислот) нижнего стереоцентра для данного соединения. Если функциональная группа располагается слева от углеродного скелета, то такой энантиомер обозначают символом L (лат. lævus – левый), если справа – D (лат. dexter – правый).
В настоящее время наиболее широко используется R/S-номенклатура, позволяющая охарактеризовать энантиомер по его абсолютной конфигурации. Данный вид номенклатуры основывается на присвоении хиральному атому углерода обозначения R или S в зависимости от взаимного расположения четырех связанных с ним заместителей. При этом для каждого из заместителей определяют старшинство в соответствии с правилами Кана – Ингольда – Прелога. Затем молекулу ориентируют так, чтобы младший заместитель был направлен в сторону от наблюдателя, и устанавливают направление падения старшинства остальных трех заместителей. Если старшинство уменьшается по часовой стрелке, конфигурацию атома углерода обозначают R (лат. rectus – правый). В противном случае конфигурацию обозначают S (лат. sinister – левый). Если соединение содержит только один хиральный центр, его конфигурация указывается в названии в виде приставки. Если в соединении находится несколько стереоцентров, обозначается конфигурация каждого. R/S-номенклатура не имеет непосредственной связи с (+/-)-обозначениями. Например, R-изомер может быть как правовращающим, так и левовращающим в зависимости от конкретных заместителей при хиральном атоме.
Энантиомеры обладают одинаковыми физическими и химическими свойствами (температурой кипения, температурой плавления, растворимостью, электропроводностью и др.), но в зависимости от ориентации заместителей вокруг асимметричного атома углерода по-разному реагируют с другими хиральными соединениями – этим объясняется их различие в физиологическом действии. Все аминокислоты (кроме глицина) и множество сахаров являются хиральными. При этом левовращающие L-формы не имеют ни вкуса, ни запаха, сладкий вкус обеспечивается D-формами, потому что белки-рецепторы вкусовых и обонятельных луковиц тоже хиральны [4]. В подавляющем большинстве случаев в фармакологии используются не индивидуальные энантиомеры, а оптически неактивная (рацемическая) смесь равных количеств энантиомеров, которые образуются в результате химических реакций. Синтез хиральных соединений из ахиральных реактивов всегда приводит к рацемической модификации – оптически неактивные реактивы производят оптически неактивные продукты. Рацематы отличаются от индивидуальных энантиомеров не только спектральными характеристиками, но и биологической активностью. Модифицировать биологическую активность фармакологических препаратов и разделить рацематы на энантиомеры позволяют три метода (иногда для получения лучшего результата целесообразно использовать несколько подходов).
Механический метод. В результате кристаллизации некоторых оптически активных соединений могут образовываться две формы кристаллов, похожих друг на друга как предмет и его зеркальное отображение. Их можно отделить под микроскопом механически препаративной иглой. Метод был открыт еще в XIX в. Луи Пастером, который с помощью пинцета отделил левые и правые кристаллы тартрата алюмината натрия, вследствие чего ученый стал не только основателем микробной теории болезней, но и креационистом – разрушителем эволюционных идей о спонтанном зарождении жизни. Пастеру посчастливилось выбрать одно из немногих рацемических веществ, которое саморазрешается в кристаллическую форму. Более того, ему повезло, что лаборатории в XIX в. не очень хорошо обогревались, поскольку таким свойством тартрат алюмината натрия обладает только при температуре ниже 23 °C.
Биохимический метод. Основан на том, что определенные виды микроорганизмов предпочитают одну из энантиомерных форм и «поедают» ее, вторая остается и может быть легко выделена.
Химический метод (стереоселективный синтез). В его основе лежит перевод энантиомеров при помощи оптически активных реагентов в диастереомеры, которые уже отличаются друг от друга по физическим свойствам и которые гораздо легче разделить. Идея заключается в том, что «левые» и «правые» формы вещества имеют одинаковые свойства, пока не сталкиваются с хиральным феноменом. Приведем пример: левая и правая руки одинаковы, если нужно схватить ахиральный объект типа бейсбольной биты, но неодинаковы, если речь идет о хиральном объекте, например перчатке левой руки. Для разрешения рацемата (то есть отделения двух энантиомеров) обычно используют готовое гомохиральное вещество (хиральный субстрат, хиральный вспомогательный реагент и хиральный катализатор). Продукты реакции R- и S-энантиомеров с исключительно правосторонним веществом R´, то есть R-R´ и S-R´ (называемые диастереоизомерами), не являются зеркальным отражением друг друга. Они имеют разные физические свойства, например растворимость в воде, и, значит, могут быть отделены.
Смысл разделения хиральных веществ на две части – правовращающую и левовращающую – заключается в том, что один из энантиомеров может быть биологически не активным (как S-локсиглумид) или менее активным (как S-варфарин), иметь иные пути метаболизма и вызывать другие побочные эффекты [5]. В качестве примера можно рассмотреть фармакологические свойства антибиотика широкого спектра действия левомицетина. Если эффективность левовращающей формы принять за 100, то эффективность правовращающей формы составит только 2% от нее, то есть бактерицидная активность левомицетина в 50 раз превышает таковую правомицетина. В этом нет ничего удивительного – протеины бактерий не отличаются по хиральности от протеинов человека и вращают плоскость поляризации против часовой стрелки, то есть в левую сторону. По той же причине левовращающие дофамин и ацетилкарнитин оказываются эффективнее правовращающих энантиомеров. Но не все лекарственные средства наиболее эффективны в левовращающей оптической конфигурации: у обезболивающих и противовоспалительных препаратов наблюдается противоположная тенденция. Левовращающие энантиомеры целого ряда нестероидных противовоспалительных средств обладают значительно меньшей обезболивающей активностью, чем правовращающие. Ярким примером этой закономерности является кетопрофен: левовращающий R-энантиомер лишен обезболивающей и противовоспалительной активности, при этом он токсичен, повышает риск желудочно-кишечных осложнений (рис. 3). Напротив, правовращающий S-кетопрофен (S(+)-3-бензоил-альфа-метилбензолуксусная кислота в виде трометаминовой соли), или декскетопрофен (Дексалгин®), является мощным анальгетиком с высокой противовоспалительной активностью и сниженной токсичностью [6–8].
Дексалгин® способен блокировать образование медиаторов воспаления (простагландинов), ингибируя циклооксигеназу на периферии (в органах и тканях), а также в центральной нервной системе (спинном и головном мозге) благодаря способности преодолевать гематоэнцефалический барьер. Существование центрального компонента антиноцицептивного действия препарата Дексалгин®, обусловленного подавлением синтеза простагландинов в центральной нервной системе (ЦНС), подтверждается выраженной диссоциацией между противовоспалительным и антиноцицептивным эффектом. Для осуществления центрального антиноцицептивного действия молекуле нестероидного противовоспалительного средства необходимо попасть в ЦНС из кровотока. Оптимальной доставке молекул препарата в ЦНС препятствует гематоэнцефалический барьер, который строго контролирует обмен веществ между кровью и ЦНС. Изомеры кетопрофена различаются по способности проникать в спинной мозг и супраспинальные структуры (процесс, который осуществляется в основном за счет пассивной диффузии) – у правовращающей молекулы она значительно выше, чем у левовращающей. Способность проникать через гематоэнцефалический барьер, связанная с липофильностью кетопрофена, а главное конформационной стереоизомерией правовращающих молекул, позволяет не только подавлять воспаление в его периферическом очаге, но и воздействовать на механизмы хронизации боли, снижая центральную сенситизацию ноциогенных структур спинного и головного мозга за счет подавления синтеза медиаторов воспаления в глиальной ткани [9]. Высокий анальгетический потенциал декскетопрофена сопоставим по силе и скорости наступления обезболивающего действия с центральным анальгетиком трамадолом, воздействующим через опиоидные рецепторы. При этом совместное использование этих препаратов взаимно потенцирует их обезболивающий эффект (рис. 4) [10].
Благодаря быстрому и эффективному обезболиванию, а также центральному механизму действия декскетопрофен препятствует хронизации боли, особенно в комбинации с центральным анальгетиком трамадолом, что позволяет снизить дозу препаратов и уменьшить риск развития побочных эффектов. В отличие от обычного кетопрофена, применяемого в дозе не менее 100 мг, декскетопрофен демонстрирует анальгетическое действие в минимальной дозе, превосходя по силе обезболивания такие анальгетики в стандартных дозах, как ибупрофен и трамадол, что доказано двойными слепыми плацебоконтролируемыми исследованиями (рис. 5) [11].
Декскетопрофен начинает оказывать обезболивающее действие, превосходящее плацебо, в дозе 12,5 мг, то есть в 8 раз меньшей, чем обезболивающая доза обычной рацемической смеси кетопрофена. Этот факт нельзя объяснить просто уменьшением массы действующего вещества за счет исключения бесполезных 50% левовращающих молекул. Остается предположить, что R-энантиомер кетопрофена является антагонистом S-энантиомера (декскетопрофена). Но и это еще не все: по данным рандомизированных клинических исследований, безопасность декскетопрофена значительно выше, чем у рацемической смеси, за счет исключения вредного R-энантиомера кетопрофена (таблица) [12].
Таким образом, оптические конфигурационные стереоизомеры, будучи идентичными по физико-химическим свойствам, могут различаться по биологическому действию: как по эффективности, так и по безопасности. Это делает НИОКР хиральных молекул уже известных лекарственных веществ заведомо успешными: достаточно установить, какой энантиомер эффективнее и/или безопаснее.
Трагическим свидетельством важности хиральности молекул для обеспечения безопасности лечения стал талидомид. В начале 1960-х гг. это лекарство назначалось беременным, страдавшим бессонницей, утренней тошнотой и рвотой. В то же время левовращающие S-формы талидомида обладали транквилизирующим эффектом, правовращающие D-формы оказывали тератогенное действие. К сожалению, в продажу поступила рацемическая смесь и тысячи детей родились с фокомелией (рис. 6). Если бы «неправильный» D-энантимомер был удален, талидомидной трагедии можно было бы избежать [13].
Все биологические объекты на планете Земля состоят из гомохиральных энантиомеров (имеют одинаковую направленность). При этом хиральные аминокислоты в протеинах – «левовращающие», а сахара и нуклеотиды в ДНК, РНК и метаболических путях – «правовращающие». В связи с этим энантиомерная чистота является обязательным требованием к биологическим объектам для их нормального функционирования. «Неправильные» гетерохиральные энантиомеры не могут образовывать специальные формы, необходимые энзимам, так как в этом случае аминокислота с неправильной хиральностью (когда боковые цепи беспорядочно «торчат») разрушает стабилизирующую альфа-спираль в протеинах. ДНК не может быть стабильной в форме спирали, если присутствует хотя бы один энантиомер с неверной хиральностью. Кроме того, она не может образовывать длинные цепи и соответственно хранить достаточно информации для поддержания жизни. Оптическая активность биологических систем усложняет для эволюционистов объяснение зарождения жизни на планете Земля, поскольку механизмы изначального происхождения гомохиральности в живых организмах неизвестны. Вероятность случайного образования функционального гомохирального биополимера чрезвычайно низка, так как нужна точная последовательность S-форм аминокислот во многих местах. Кроме того, для поддержания жизни необходима комбинация множества гомохиральных полимеров, так что вероятности должны быть умножены. Случай, таким образом, не может объяснить самозарождение сложных гомохиральных биомолекул из «первичного бульона» и уж тем более обосновать, почему аминокислоты всех живых существ на Земле имеют однонаправленную левостороннюю хиральность, а сахара и нуклеотиды вращают плоскость поляризации в противоположную сторону [4].
Гомохиральные биологические вещества рацемизируются со временем. Это лежит в основе метода датирования по рацемизации аминокислот. Метод не очень надежен, поскольку степень рацемизации зависит от температуры, pH и вида аминокислоты. Но сам процесс рацемизации когда-то живых биологических систем подтверждает преобладание в природе тенденций энтропии – от жизни к смерти, от упорядочения к хаосу [14].
Ввиду того что почти все биомолекулы хиральны, оптическая стереоизомерия имеет решающее значение при синтезе сложных соединений, обладающих фармакологическими свойствами. Процесс жизнедеятельности представляет собой энантиоселективный синтез оптически активных биологически активных соединений. Мы едим оптически активную пищу. Протеины, составляющие наши мускулы, нейромедиаторы в нервной системе, энзимы и гормоны в крови оптически активны. В очаге воспаления с помощью оптически активной циклооксигеназы второго типа синтезируются оптически активные медиаторы воспаления, которые значительно лучше ингибируются оптически активным декскетопрофеном, чем рацемической смесью. Естественные вещества оптически активны, поскольку гомохиральные энантиомеры – это жизнь, а рацематы – результат энтропии, конфигурационного хаоса и в конечном итоге смерти. Использование оптически активных лекарственных средств, таких как Дексалгин®, – это движение к жизни. Применение подобных препаратов позволяет избежать не только побочных эффектов у принимающих их пациентов, но и врожденных пороков развития (как в случае с талидомидом) у будущих поколений.