Лейкодистрофия головного мозга у взрослых что это
Лейкодистрофия
Лейкодистрофия — нейродегенеративное заболевание, обусловленное наследственным нарушением обмена веществ с накоплением в головном и спинном мозге метаболитов, провоцирующих разрушение миелина. Манифестирует в основном в детском возрасте задержкой психомоторного развития, двигательными расстройствами, поражением зрительных и слуховых нервов, гидроцефалией, эпилептическими приступами. Диагностируется лейкодистрофия по данным неврологического статуса, анамнеза, генетических исследований, МРТ или КТ картины головного мозга, биохимических анализов. Лечение симптоматическое. При раннем выявлении и медленном прогрессировании возможна трансплантация пуповинной крови или костного мозга.
МКБ-10
Общие сведения
Лейкодистрофия получила свое название в связи с поражением белого вещества мозга (с греческого leukos — белый). Различают около 60 разновидностей лейкодистрофии, определяющихся видом генной аномалии и возрастом манифестации клинических проявлений. Наряду с отдельными воспалительными поражениями ЦНС (например, лейкоэнцефалитом Шильдера) лейкодистрофия относится к синдрому диффузного склероза мозга. При этом доминирующее поражение миелина сближает ее с демиелинизирующими заболеваниями (рассеянным склерозом, РЭМ и пр.), а отдельные формы можно отнести к липидозам.
К основным формам лейкодистрофии относятся метахроматическая, суданофильная, глобоидно-клеточная, дегенерация Ван-Богарта-Бертрана, болезнь Александера, вариант Галлервордена-Шпатца. Наиболее распространены первые 3 вида лейкодистрофии. Их встречаемость колеблется от 0,4 до 1 случая на 100 тыс. новорожденных. Ряд форм лейкодистрофии являются настолько редкими, что в мировой литературе по неврологии описано всего несколько сотен их клинических наблюдений. В зависимости от возрастного периода, в котором дебютирует лейкодистрофия, каждая ее форма может подразделяться на инфантильный, поздний инфантильный, ювенильный и взрослый вариант.
Причины возникновения лейкодистрофии
В своей основе каждая лейкодистрофия имеет генетическую аномалию определенного фермента. Вид аномалии и локализация генной мутации пока установлены лишь для наиболее встречающихся форм патологии. В большинстве случаев лейкодистрофия имеет аутосомно-рецессивный путь наследственной передачи, однако отдельные ее формы могут наследоваться сцеплено с полом. Кроме того, не одиноки случаи спонтанных мутаций. Генетически детерминированный энзимный дефект ведет к обменным нарушениям (чаще в метаболизме липидов) с отложением определенного метаболита в нервных структурах и отдельных соматических органах, в первую очередь в печени и почках.
Следствием метаболической аномалии является разрушение миелина оболочек нервных стволов и проводящих путей, гибель нейронов с замещением их разрастающейся глиальной тканью. Морфологически лейкодистрофия характеризуется диффузными и симметрично расположенными в полушариях головного мозга зонами гибели миелина, скоплением продуктов миелинового распада, усиленной пролиферацией глии. В отдельных нозологических вариантах лейкодистрофия имеет специфическую морфологическую картину — метахроматическое или суданофильное окрашивание продуктов миелинового распада, скопление в зонах демиелинизации глобоидных клеток и т. п.
Симптомы лейкодистрофии
В большинстве случаев лейкодистрофия дебютирует в раннем детском возрасте. Новорожденные, как правило, выглядят здоровыми. Определенный период они нормально развиваются, а затем постепенно возникают различные неврологические симптомы, отличающиеся неуклонным прогрессированием. Скорость нарастания симптомов тем выше, чем раньше манифестировала лейкодистрофия. Ведущими проявлениями выступают прогрессирующая олигофрения, ухудшение зрения, тугоухость, эписиндром, спастические парезы. Первыми симптомами лейкодистрофии могут быть атаксия, мышечно-тонические расстройства (гипо- или гипертонус, мышечные подергивания), экстрапирамидные проявления, изменения поведения. Затем возникают эпиприступы, бульбарные проявления, снижается слух и зрение, отмечается интеллектуальное снижение с постепенной утратой ранее приобретенных навыков. Сенсорные расстройства не характерны. На поздних этапах развития болезни наблюдаются параличи, выраженная олигофрения, грубое расстройство глотания, амавроз, глухота. В терминальной фазе обычно отмечается децеребрационная ригидность.
Виды лейкодистрофии
Метахроматическая лейкодистрофия в зависимости от манифестации имеет 4 варианта. Врожденный вариант дебютирует в первые 1-3 мес. жизни задержкой развития и судорожным синдромом; дети не достигают возраста 1 года. Позднедетский вариант метахроматической лейкодистрофии начинается в период от 1 до 3 лет с мышечной гипотонии и слабости, атаксии, задержки психического развития (ЗПР). Затем формируется спастическая тетраплегия, афазия, псевдобульбарный синдром. В редких случаях пациенты доживают до 10-летнего возраста. Ювенильный вариант манифестирует в 4-6 лет и длится в среднем 7 лет. Взрослый вариант дебютирует в третьей декаде жизни, иногда позднее, продолжительность жизни пациентов от начала клиники варьирует в пределах 10-20 лет.
Суданофильная лейкодистрофия наследуется сцеплено с Х-хромосомой и имеет несколько разновидностей. Лейкодистрофия Пелицеуса-Мерцбахера может стартовать на 1-ом году жизни или в 3-4 года. Первым признаком является крупноразмашистый нистагм, позже возникает ЗПР, мозжечковая атаксия, гиперкинезы, парезы. Наибольшее прогрессирование происходит в возрасте до 10 лет, затем заболевание принимает замедленное течение с длительными ремиссиями. Пациенты могут жить до зрелого возраста. Адренолейкодистрофия — вариант, при котором лейкодистрофия сочетается с надпочечниковой недостаточностью. Характеризуется прогрессирующим течением с летальным исходом спустя 6-8 лет от начала клиники.
Глобоидно-клеточная лейкодистрофия (болезнь Краббе) — липоидоз с накоплением в очагах демиелинизации галактоцереброзида и образованием больших округлых глобоидных клеток. Раннедетский вариант развивается в первом полугодии жизни с гипервозбудимости и периодической гипертермии, задерживается психомоторное развитие, нарастает тонус мышц, затем развивается спастический тетрапарез, олигофрения, эписиндром, возможен опистотонус. В годовалом возрасте наступает летальный исход. Позднедетский вариант более редкий, манифестирует ухудшением зрения.
Спонгиозная дегенерация Ван-Богарта-Бертрана характеризуется эписиндромом, гиперсомнией, выраженной гидроцефалией с увеличением размеров головы, вызывающей амавроз атрофией зрительных нервов. Резкая внутричерепная гипертензия приводит к расхождению черепных швов, регистрируемому при рентгенографии черепа. Пациенты с этой формой лейкодистрофии погибают до 3-летнего возраста.
Болезнь Александера (лейкодистрофия с волокнистой формацией) обусловлена мутацией гена, ответственного за синтез GFAP белка. В результате происходит накопление в клетках глии аномального GFAP белка, содержащего волокна Розенталя. Неонатальный вариант имеет тяжелое течение с летальным исходом к концу 1-го года. Инфантильный вариант встречается примерно в половине случаев, проявляется в первые 1-2 года жизни ЗПР, затем присоединяются спастические парезы, атаксия, гидроцефалия. Дети погибают спустя несколько лет. Ювенильная лейкодистрофия Александера дебютирует в период от 4-х до 10-летнего возраста, протекает с преимущественно стволовой симптоматикой. Продолжительность жизни колеблется в пределах 10-30 лет. Взрослый вариант отличается поздней манифестацией и относительно медленным течением в пределах 10 и более лет.
Лейкодистрофия Галлервордена-Шпатца чаще всего стартует в 10-летнем возрасте. Проявляется дисфункцией стриопаллидарной системы, затем на фоне гиперкинезов прогрессирует тетрапарез, развивается гемералопия и пигментный ретинит, наблюдается снижение интеллекта, возникают эпиприступы.
Диагностика лейкодистрофии
Диагностический поиск требует привлечения ряда специалистов: невролога, педиатра, медицинского генетика, для диагностики расстройств зрения и слуха — отоларинголога и офтальмолога. Важное значение имеет изучение анамнеза болезни (возраст и симптомы дебюта, последовательность развития клиники) и семейного анамнеза (наличие лейкодистрофии у родственников). Нейросонография через родничок и эхо-энцефалография у пациентов более старшего возраста, как правило, выявляет повышение интракраниального давления. Лейкодистрофия сопровождается существенным увеличением концентрации белка, обусловленным разрушением церебральных клеток, что определяется при исследовании цереброспинальной жидкости.
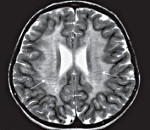
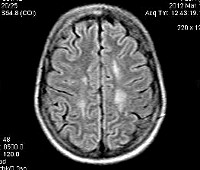
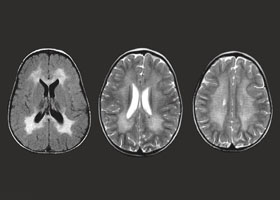
С целью диагностики вида метаболической аномалии проводится целый ряд биохимических тестов с определением уровня ферментов и накапливающихся метаболитов. Очаги демиелинизации хорошо визуализируются при помощи МРТ, могут быть обнаружены и на КТ головного мозга. Обычно демиелинизация видна на МРТ головного мозга еще до клинической манифестации лейкодистрофии. Благодаря развитию генетики, лейкодистрофия имеет разработанную ДНК-диагностику, а отдельные ее формы (метахроматическая, адренолейкодистрофия, глобоидно-клеточная) — возможность пренатального диагностирования.
Лечение лейкодистрофии
На сегодняшний день лейкодистрофия не имеет эффективных способов терапии, позволяющих купировать прогрессирование симптомов. Проводится симптоматическое лечение — в основном дегидратационная и антиконвульсантная терапия. Единственным методом, способным увеличить продолжительность жизни пациентов с лейкодистрофией и улучшить качество их жизни, является трансплантация пуповинной крови или пересадка костного мозга. Трансплантация приводит к нормализации метаболизма. Однако этот процесс занимает длительное время (от 12 до 24 мес.), в течение которого продолжается прогрессирование лейкодистрофии. Поэтому зачастую тяжелая инвалидизация или гибель пациента наступает даже после успешной трансплантации.
Следует подчеркнуть, что трансплантация никак не влияет на уже развившийся неврологический дефицит, она лишь позволяет приостановить его дальнейшее прогрессирование. В связи с тем, что эффект такого лечения наступает спустя 1-2 года, оно целесообразно в случае ранней доклинической диагностики лейкодистрофии (при соответствующей настороженности родителей рожденного ребенка в связи с наличием подобной патологии в семье) или при медленно прогрессирующем варианте течения. Кроме того, необходимо учитывать, что трансплантация связана с риском ряда серьезных осложнений, таких как отторжение, реакция «трансплантат против хозяина», развитие инфекций.
Лейкодистрофии
Лейкодистрофии – это группа генетических заболеваний, связанных с нарушением обмена веществ и сопровождающихся накоплением в белом веществе мозга метаболитов, которые разрушают миелин. Обычно первые симптомы начинают появляться у пациентов в детском возрасте:
Лечение симптоматическое, но при своевременной диагностике и медленном течении заболевания возможна стабилизация состояния после аллогенной (от другого человека) трансплантации костного мозга или стволовых клеток.
Причины лейкодистрофии
Лейкодистрофии возникают в результате поломки генов, отвечающих за метаболизм миелина, после чего возникают метаболические аномалии, приводящие к разрушению белого вещества мозга. В большинстве случаев заболевание наследуется по аутосомно-рецессивному типу, но возможно и наследование, сцепленное с Х-хромосомой, как это случается при адренолейкодистрофии.
Родителям, у которых были дети с лейкодистрофией, необходима консультация генетика при планировании следующей беременности.
Симптомы лейкодистрофии
Дети с лейкодистрофией рождаются клинически здоровыми. Какое-то время они развиваются нормально, но постепенно начинают проявляться признаки поражения ЦНС, которые неумолимо нарастают. Чем раньше началась манифестация, тем выше скорость прогрессирования болезни и тем более неблагоприятный прогноз.
Для каждого вида заболевания характерны свои симптомы и очередность их возникновения, но общие черты все же есть:
Есть ряд симптомов, которые характерны только для определенных видов лейкодистрофии. Например, при адренолейкодистрофии, помимо мозговых нарушений, поражаются надпочечники.
Классификация лейкодистрофий
Существует около 60 видов лейкодистрофий. Они различаются видом генетической поломки и возрастом проявления симптомов. Чаще всего встречаются три вида, соответственно, они наиболее изучены:
Диагностика и лечение лейкодистрофии
Диагностика лейкодистрофии требует комплексного подхода с участием специалистов разного профиля: неврологов, офтальмологов, отоларингологов и др. Одним из главных методов обнаружения болезни является МРТ. Она четко визуализирует очаги демиелинизации еще до начала клинических проявлений. По мере прогрессирования заболевания МРТ-картина также ухудшается. К уточняющим методам диагностики относятся:
Единственным методом лечения лейкодистрофии на сегодняшний день является аллогенная трансплантация костного мозга или стволовых клеток. Она позволяет нормализовать метаболизм миелина, стабилизировать процесс демиелинизации и замедлить или остановить прогрессирование заболевания.
Наилучшие результаты достигаются либо при медленно текущей форме, либо доклиническом назначении трансплантации. В связи с этим большое значение отводится своевременной диагностике в семьях с уже имеющимися больными детьми.
Медико-генетический центр «Геномед» обладает возможностями для молекулярно-генетической диагностики данного заболевания как уже у рожденных пациентов, так и в рамках пренатального скрининга.
Лейкодистрофия
Общие сведения
Лейкодистрофия головного мозга — врожденное заболевание нервной системы. Википедия дает следующее определение данной патологии: «это группа тяжелых наследственных заболеваний, которые характеризуются поражением белого вещества головного мозга спинного». Это нейродегенеративные, достаточно редкие заболевания, для которых характерно нарушение обмена веществ, связанного с врожденным дефектом того или иного фермента, что сопровождается накоплением метаболитов, которые вызывают разрушение миелина белого вещества мозга и прогрессирующую его дегенерацию.
Группа лейкодистрофий включает более 60 форм, которые отличаются видом мутации и возрастом проявления болезни, что влияет на прогноз заболевания. В зависимости от возраста формы могут подразделяться на варианты: инфантильный, ювенильный и взрослый. Все эти заболевания сопровождаются нарушением передачи нервных импульсов в ЦНС, в связи с чем у больных возникают сначала двигательные, а затем и интеллектуальные расстройства, задержка психомоторного развития. По мере разрушения миелина расстройства прогрессируют и за несколько лет у больных развивается тяжелая физическая и психическая деградация. Некоторые формы имеют отличительные симптомы, связанными с поражением и других органов кроме ЦНС. Многие формы настолько редко встречаются, что даже в мировой медицинской литературе описано несколько сотен случаев и наблюдений за больными.
Патогенез
Генетически обусловленный дефект приводит к нарушению обмена (чаще нарушается метаболизм липидов). Это влечет отложение того или иного вещества (метаболита) в тканях. Прежде всего поражается головной мозг и спинной, почки и печень. Токсические метаболиты вызывают разрушение миелина, гибель или атрофию нейронов (клетки нервной ткани), при этом погибшие нейроны замещаются глиальной тканью (соединительная ткань), которая разрастается. Любая лейкодистрофия характеризуется основными патогенетическими процессами: диффузная гибель миелина в полушариях, скопление продуктов, которые образуются после его распада и усиленное разрастание глии. При отдельных формах отмечается специфическая картина — метахроматическое (суданофильное) окрашивание распавшихся продуктов миелина или скопление в зонах распада характерных глобоидных клеток. При болезни Александера в результате мутации в нервной ткани накапливается генетически измененный (мутантный) белок GFAP.
Классификация
Наследственные лейкодистрофии по характеру являются гипомиелинизирующими — миелин изначально не образуется или образуется в недостаточном количестве. Большинство из этих заболеваний наследуется по аутосомно-рецессивному признаку — это значит, что вероятность заболевания у ребенка составляет 25%, если оба родителя-носители гена. В таких случаях с одинаковой частотой в семьях заболевают мальчики и девочки, рожденные от близкородственных браков.
Есть форма, которая характеризуется наследованием, сцепленным с Х хромосомой (адренолейкодистрофия) — она передается Х-хромосомой матери-носительницы болезни. Чаще всего встречаются метахроматическая лейкодистрофия, Пелицеуса-Мерцбахера (или суданофильная), адренолейкодистрофия, болезнь Краббе, Александера и Канавана. Кратко остановимся на этих формах.
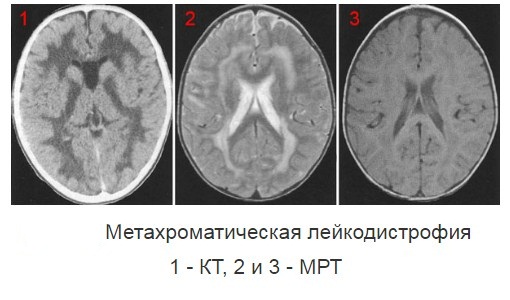
Метахроматическая лейкодистрофия — одна из частых и изученных форм. Девочки и мальчики поражаются одинаково часто. При данной патологии отмечается дефицит лизосомного фермента арилсульфатазы. Этот дефект приводит к тому, что в белом веществе головного мозга, периферических нервов и органах (печень, легкие, почки, сердце) накапливаются специфические метаболиты сульфатиды, которые при гистохимическом исследовании дают специфическое метахроматическое окрашивание. Функция внутренних органов не страдает, а в мозговом веществе прогрессируют дегенеративные изменения. Метахроматическая лейкодистрофия по клинике делится на типы: врожденный, поздний инфантильный, ювенильный (ранний и поздний) и взрослый. Все типы протекают с ухудшением двигательной и психической функции, но эти нарушения возникают в разный возрастной период и степень прогрессирования тоже разная.
Врожденная метахроматическая форма развивается до 3-х месяцев и проявляется эпилептическим синдромом и задержкой развития. К ним присоединяется парез и прогрессирующие расстройства глотания. Малыши умирают на первом году жизни.
Поздняя детская форма — самая частая. Заболевание проявляется в 6 месяцев — 4 года. Дети, которые нормально развивались до 8-9 месяцев к году жизни теряют приобретенные навыки — у них нарушается походка, они перестают сидеть и ходить, появляется разболтанность суставов, снижаются сухожильные рефлексы и прогрессирует мышечная слабость, нарушается функция глотания и ухудшается зрение (атрофия зрительных нервов). Постепенно развивается нарушение функции ног, а затем и рук (спастический тетрапарез), нарушения глотания. При хорошем питании через желудочный период продолжается 1-2 года. Но потом двигательная и когнитивная функция быстро прогрессируют, и такие дети умирают в течение 5 лет с начала заболевания.
Ведущий симптом при ювенильной форме (6-10 лет) — нарушение координации движений (мозжечковая атаксия). Больные неустойчивы, ходят неуверенно с широко расставленными ногами, отмечается шаткость при походке. С поздней ювенильной формой больные доживают до взрослого возраста. Взрослая форма проявляется нарушением поведения, из-за чего пациентов часто принимают за психиатрических больных, и снижением когнитивной функции. Постепенно развиваются нарушения движений. Дети редко доживают до десяти лет.
Взрослая форма начинается после пубертата в период до 50-60-лет. Начинается с психических расстройств (психопатия, шизофреноподобный синдром). Также развиваются полинейропатии. Если сравнивать с другими возрастными вариантами, то изменения прогрессируют медленно и заканчивается заболевание тетрапарезом и возрастной деменцией.
Лейкодистрофия Пелицеуса-Мерцбахера связана с генетическим дефектом синтеза апопротеина — белка, который важен для функции клеток олигодендроцитов, участвующих в миелинизации аксонов. Передается по аутосомно-рецессивному признаку: если оба родителя носители мутантного гена в 25% рождается больной ребенок. Второй тип наследования — сцепленная с полом передача (только мальчикам в семье или девочкам).
Проявляется болезнь рано — с 5 до 10 месяцев и имеет медленное развитие. В течение болезни появляется «светлый» промежуток, очень долго длящийся. В связи с этим больные доживают до зрелого возраста и летальный исход возможен только в возрасте 20-30 лет. Болезнь Пелицеуса-Мерцбахера в младенчестве проявляется кивательными движениями головы, блуждающими движениями глаз нистагмом, задержкой развития. Когда малыш начинает ходить, у него появляется атаксия и спастичность конечностей, хореоатетоз (сочетание быстрых и порывистых движений с медленными судорожными). Постепенно развивается нарушение речи и атрофия зрительных нервов. Умственное развитие детей не страдает.
Адренолейкодистрофия связана с мутациями гена АВСD1 и изменением белка ALDP. При генетической диагностике обнаруживают мутации гена ABCD1 (это могут точечные мутации, делеции нуклеотидов и крупные делеции). При этом нарушается транспорт нормальных жирных кислот в миелиновую оболочку и образуются аномальные сверхдлинноцепочечные жирные кислоты в большом количестве, оказывающие токсическое действие на миелин. В результате токсического действия концентрация миелина резко снижается. Помимо поражения ЦНС и периферической нервной системы отмечается поражение надпочечников в виде их недостаточности. В зависимости от преобладания симптомов в клинике выделяют церебральную форму, периферическую и форму только с надпочечниковой недостаточностью.
Церебральная Х-сцепленная адренолейкодистрофия может проявляться в детском возрасте (пик 7-8 лет, детская форма), юношеском (манифестирует в 10-21 лет, юношеская форма) и во взрослом возрасте (30-50 лет, встречается редко). Детская и юношеская формы характеризуются быстрым прогрессированием двигательных нарушений, интеллектуальных и поведения. В детском возрасте наиболее часто встречаются гиперактивное поведение или противоположность ему — аутистическое поведение. У детей возникает агрессивность, снижается память и внимание, возникают проблемы с обучением, нарушается походка и прогрессирует слабоумие.
Значительно реже бывают нарушения зрения и слуха, а также надпочечниковая недостаточность (низкое давление, гиперпигментация кожи, слабость, рвота и тошнота, возникающие периодически). В юношестве прогрессирует умственная отсталость, прогрессивно ухудшается память, развивается спастический тетрапарез (нарушается двигательная функция рук и ног), снижается зрение и слух, появляются судороги. У взрослых заболевание проявляется деменцией и шизофренией. Также у больных нарушается функция глотания и зрения (выпадают поля зрения). Чаще всего прогноз неблагоприятный: несколько лет от начала первых симптомов заболевание прогрессирует и приводит к смерти.
Лейкодистрофия Краббе связана с дефицитом определенного лизосомного фермента, что обусловлено мутациями в гене GALC. При недостатке этого фермента в нервной ткани накапливается галактозилсфингозин — высокотоксичное вещество, вызывающее демиелиенизацию и гибель клеток с образованием в очагах больших глобоидных образований. Болезнь Краббе бывает нескольких подтипов: инфантильный, поздний инфантильный, взрослый и ювенильный. Самая частая из всех форм — инфантильная, она считается классической и составляет до 90% всех случаев.
Первые проявления заболевания наблюдаются в 3-6 месяцев. Сначала у малышей появляется гипервозбудимость, повышенный мышечный тонус, рвота, гастроэзофагеальный рефлюкс, плохая прибавка веса и задержка развития (до этого периода ребенок развивался нормально). На втором этапе заболевания отмечается регресс психомоторного развития (теряются все навыки), появляются судороги и опистотонус, наступает атрофия зрительных нервов (слепота) и прогрессирует гипотрофия (нарушение питания). На третьей стадии заболевания ребенок полностью теряет произвольные движения, и у него возникает децеребрационная поза, которая свидетельствует о тяжелом поражении головного мозга.
Лейкодистрофия Канавана обусловлена мутацией гена ASPA, ответственным за синтез фермента аспартоацилазы. Этот фермент расщепляет токсичный N-ацетиласпартат. Накопление токсичного вещества вызывает дегенерацию серого и белого вещества мозга. Тип наследования аутосомно-рецессивный с передачей гена от обоих родителей.
Болезнь Кэнэвэн-ван-Богарта-Бертрана развивается постепенно и сначала ребенок развивается нормально. Через несколько месяцев навыки начинают угнетаться, снижается мышечная активность, увеличивается спастичность мышц, взгляд становится нефиксированным, затрудняется вскармливание из-за нарушений глотания, а также постепенно увеличивается объем головы. Болезнь прогрессирует стремительно, но произвольные движения пока сохраняются. Потом ребенку становится трудно фиксировать голову, развиваются спастические парезы рук и ног. По мере прогрессирования глотательный рефлекс утрачивается и ребенка кормят через пищеводный зонд. Развиваются судорожные припадки, реакции на раздражители отсутствуют и утрачивается зрение — эти симптомы являются пиком заболевания. Развитие симптомов может быть быстрым (в течение нескольких месяцев) и длительным (до 10 лет). Бактериальные или вирусные инфекции — частые осложнения этого заболевания.
Причины
Как было указано выше, причиной этой группы заболеваний являются генные мутации и наследование патологии от родителей. Вид мутаций установлен для наиболее распространенных форм. Мутации выявляются в генах, кодирующих различные лизосомальные ферменты:
Симптомы
В зависимости от формы лейкодистрофия у ребенка проявляется или в грудном возрасте (первые месяцы) или раннем детстве. До этого времени ребенок развивается нормально и не отстает от сверстников. Постепенно развивающиеся изменения в ткани мозга (головного или спинного) проявляются неврологическими расстройствами.
Первыми появляются двигательные нарушения: ухудшается координация, ребенку трудно удерживать тело в равновесии, он перестает сидеть и ходить. Развивается мышечная слабость, изменяется тонус мышц (чаще всего он повышается, но может снижаться), появляются мышечные подергивания, а потом судорожные приступы. К двигательным расстройствам присоединяются психические нарушения (меняется поведение), ухудшается интеллект и память. Вышеперечисленные симптомы неуклонно прогрессируют. Постепенно ухудшаются слух и зрение. На поздних стадиях развиваются параличи, выраженная олигофрения, слепота, глухота, ребенок теряет возможность глотать. В терминальной стадии наблюдается децеребрационная ригидность. Больной лежит в позе разгибания. При этом шея и позвоночник напряжены, а голова запрокинута, ноги разогнуты и повернуты внутрь, могут быть скрещены. Стопы и руки разогнуты, а пальцы сжаты в кулак. Скорость прогрессирования симптомов заболевания больше, чем раньше проявились первые симптомы. Периферическая нейропатия у ребенка — важная черта метахроматической лейкодистрофии и болезни Краббе, при которых нарушается метаболизм липидов миелина.