Лимфоваскулярная инвазия при рмж что это
Лимфоваскулярная инвазия при рмж что это
хирург-онколог, маммолог, кандидат медицинских наук
Ленинградская область, Всеволожский район, пос.Кузьмоловский, Заозерная ул., 2
Врач в третьем поколении. Закончил в 1998 году с отличием Санкт-Петербургскую государственную медицинскую академию им. И.И. Мечникова, после чего сразу же поступил в клиническую ординатуру по хирургии этой же академии. Во время обучения в клинической ординатуре, которую с отличием закончил в 2000 году, получил специализацию по онкологии (1999). Начиная с 1999 года, обучение проводилось на базе Ленинградского областного онкологического диспансера (отделение общей онкологии). С 2000 по 2004 год проходил обучение в аспирантуре и в 2004 году защитил кандидатскую диссертацию на тему «Хирургическое и адъювантное лечение ранних форм рака молочной железы». Имею действительные сертификаты по хирургии (2021) и онкологии (2018), реконструктивной и пластической хирургии (2019). Являюсь лучшим маммологом Санкт-Петербурга 2016 года по версии сайта НаПоправку, лучшим маммологом Санкт-Петербурга в 2020 и 2021 годах по версии Prodoctorov.Ru
Лечу рак молочной железы по федеральным квотам в Клинической больнице Российской академии наук, принимаю и лечу пациентов в клинике онкологических решений ЛУЧ
С 2004 года являюсь главным исследователем и координатором международных клинических исследований по раку молочной железы в Ленинградском областном клиническом онкологическом диспансере, клинике онкологических решений ЛУЧ.
Имею более 10 печатных работ, в том числе в центральной зарубежной печати.
Рабочий телефон +7921 945 33 18
Мобильный телефон +7 921 945 33 18
Телефон администратора +7 981 710 40 41
Рак молочной железы. Основы патологии и молекулярной биологии.
Факты о патологии:
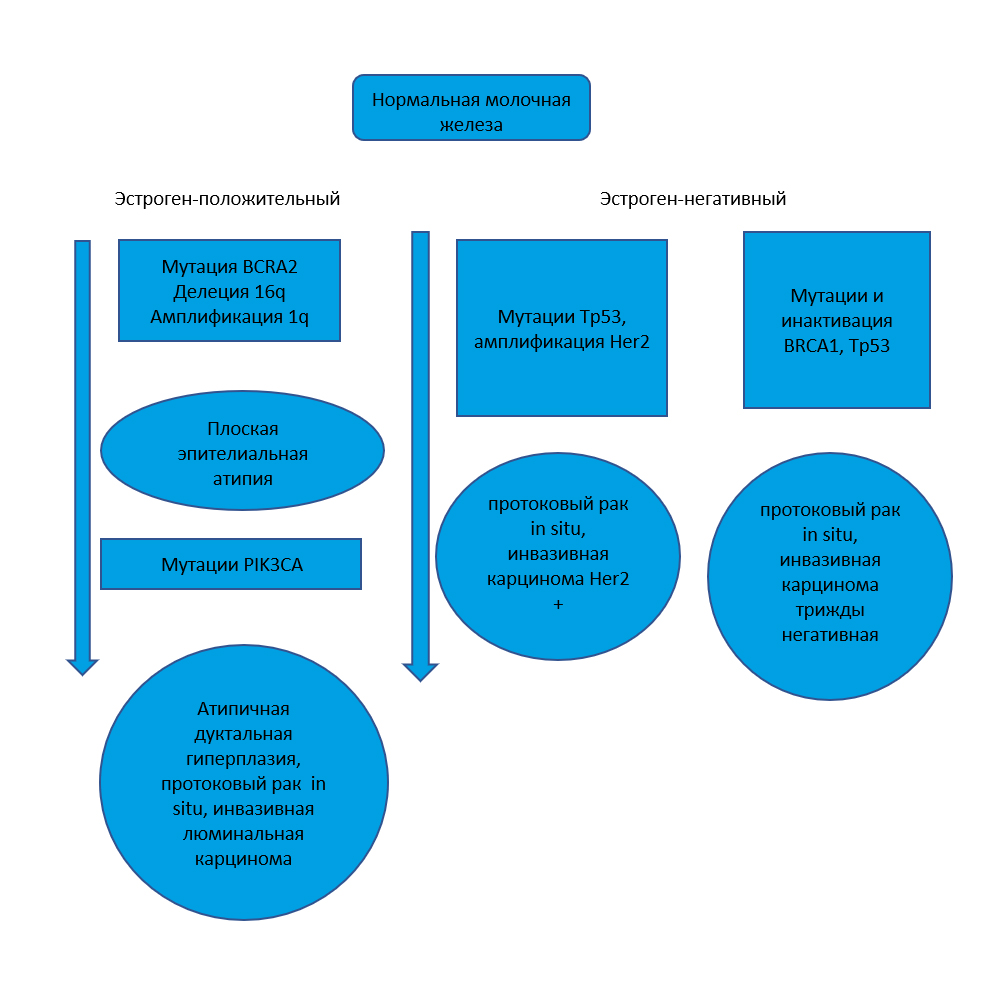
Молекулярные пути прогрессии рака молочной железы:
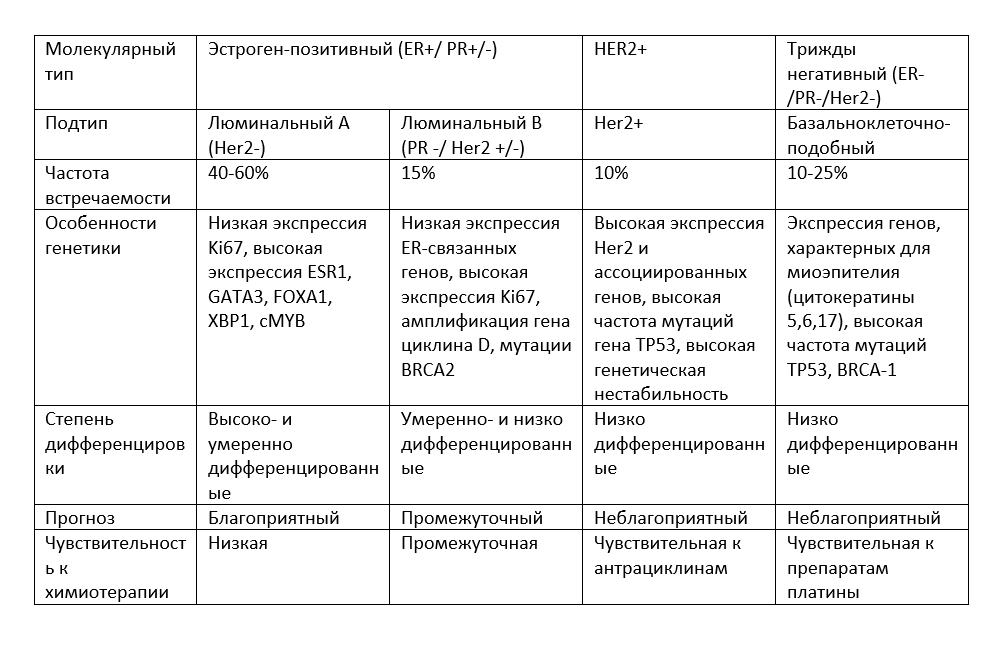
Молекулярные подтипы РМЖ:
Морфологические формы РМЖ:
Клональная пролиферация опухолевых клеток из терминальной части протоково-долькой единицы. Базальная мембрана и слой миоэпителия сохранен. Возможно распространение опухолевых клеток по протокам в пределах сегмента молочной железы.
Гистологические формы DCIS: с комедо-паттерном, крибриформная, микропапиллярная, папиллярная, болезнь Педжета, апокриновая, нейроэндокринная, перстневидноклеточная, светлоклеточная.
Клональная пролиферация опухолевых клеток из терминальной части протоково-долькой единицы c нарушенным межклеточным сцеплением, что связано с нарушенной экспрессией Е-кадгерина (мутации гена CDH1).
Большинство инвазивных карцином представляют собой протоковые карциномы, не классифицируемые как специфические подтипы. Оценка степени дифференцировки их проводится по системе Nottingham Histologic Score, которая учитывает наличие тубулярного паттерна в опухоли, степень ядерного полиморфизма, митотический индекс.
Специфические морфологические паттерны, встречающиеся при инвазивной карциноме (IBC-NST): медуллярный, нейроэндокринный, остеокласто-подобный, плеоморфный, хориокарциномо-подобный, меланоцито-подобный, онкоцитарный, липидоклеточный, богатый гликогеном светлоклеточный, себацеозный.
Выделение этих групп связано не только с особенностями морфологии, но и наличием специфических генетических аберраций, прогноза и чувствительности к терапии:
— дольковая карцинома ассоциированная с мутациями гена CDH1, кодирующего Е-кадгерин. Высокий риск метастазирования, особенно по брюшине, забрюшинной клетчатке, оболочках мозга, в органы желудочно-кишечного тракта, яичник, матку.
— карцинома с медуллярным паттерном ассоциированная с подавлением активности гена BRCA1
— муцинозная (коллоидная) карцинома
— тубулярная карцинома
— крибриформная карцинома
— папиллярная карцинома
— апокриновая карцинома
— микропапиллярная карцинома
— метапластическая карцинома
— секреторная карцинома
— мукоэпидермоидная карцинома
Современный взгляд на вопросы диагностики и верификации поражения аксиллярных лимфатических узлов при раннем раке молочной железы
Полный текст
Аннотация
Поражение аксиллярных лимфатических узлов является одним из важнейших прогностических факторов, существенно влияющих на стратегию лечения при раннем раке молочной железы (РМЖ). Риск аксиллярного метастазирования напрямую зависит от ряда факторов (возраста пациенток, размера опухоли, наличия лимфоваскулярной инвазии и биологических характеристик карциномы). Оценка статуса регионарных лимфоузлов у больных ранним РМЖ включает клинический осмотр регионарных зон и ультразвуковое исследование (УЗИ), при котором возможно оценить форму, контуры и структуру лимфатических узлов. Чувствительность УЗИ в оценке статуса регионарных лимфатических узлов напрямую зависит от биологического подтипа опухоли; минимальный уровень чувствительности УЗИ в оценке статуса лимфатических узлов отмечен для люминального HER2-негативного рака (менее 40%), и максимальная чувствительность показана для тройного негативного и HER2+ подтипов заболевания (68–71%). Клинический осмотр и современное УЗИ являются наиболее доступными методами оценки статуса регионарных лимфатических узлов, однако вероятность недооценки их метастатического поражения имеют около 1/4 больных. Верификация диагноза на предоперационном этапе (тонкоигольная биопсия/core-биопсия под ультразвуковой навигацией) позволяет минимизировать число ошибок регионарного стадирования. Биопсия «сторожевого» («сигнального») лимфатического узла (БСЛУ) является в настоящее время «золотым стандартом» регионарного лечения у больных с ранними стадиями РМЖ. В серии рандомизированных исследований (NSABP B-32, ACOSOG Z0011) показана безопасность отказа от регионарной лимфодиссекции в пользу БСЛУ не только при клинически негативных лимфатических узлах, но и у пациенток с метастазами в ≤2 сигнальных лимфатических узлах, при условии выполнения органосохраняющего лечения и последующей лучевой терапии. Качественное регионарное стадирование, выбор лечебного алгоритма в соответствии с биологическими характеристиками карциномы, проведение максимально эффективных современных лекарственных режимов, проведение оптимальной лучевой терапии позволяют не только минимизировать объем хирургического лечения, но и достичь высоких отдаленных результатов выживаемости, обеспечить отличные функциональные результаты и высокое качество жизни у пациенток с пораженными аксиллярными лимфатическими узлами.
Ключевые слова
Полный текст
Поражение аксиллярных лимфатических узлов является одним из важнейших прогностических факторов, существенно влияющих на стратегию лечения при раннем раке молочной железы (РМЖ) [1, 2]. До открытия молекулярно-генетической классификации и деления РМЖ на биологические подтипы именно размер первичной опухоли и статус регионарных лимфатических узлов считались самыми важными факторами, на основании которых планировался лечебный алгоритм и оценивался риск развития рецидива заболевания. Пациенткам с N+ статусом вне зависимости от других биологических характеристик традиционно назначались более агрессивные режимы лечения как локорегионарного, так и системного [3–5]. Однако накопление наших знаний о роли биологии опухоли в прогнозе заболевания и появление новых эффективных режимов лекарственной терапии позволили пересмотреть наши взгляды на клиническое и прогностическое значение поражения аксиллярных лимфатических узлов при раннем РМЖ [6, 7].
Риск аксиллярного метастазирования при раннем РМЖ напрямую зависит от ряда факторов (размера опухоли, наличия лимфоваскулярной инвазии и биологических характеристик карциномы). Причем поражение аксиллярных лимфатических узлов описано даже у больных с неинвазивным раком; при протоковой карциноме in situ (DCIS) без признаков инвазивного роста в 0,8% случаев при выполнении аксиллярной лимфодиссекции выявляются метастазы в лимфатических узлах, а при DCIS с микроинвазией поражение аксиллярных лимфатических узлов имеют уже 9,7% пациенток [8, 9]. Частота выявления аксиллярных метастазов при размерах опухоли T1-2 составляет 28–36% [8, 10]. При крупных размерах опухоли (более 5,0 см) вероятность поражения аксиллярных лимфатических узлов кратно возрастает. По данным M. Chung и соавт., у больных с клинической стадией T3N0M0 на этапе хирургического лечения аксиллярные метастазы в сторожевых лимфатических узлах выявляются уже в 73% случаев, что требует выполнения регионарной лимфодиссекции практически всем больным с карциномами более 5 см [11].
По мнению ряда авторов, риск аксиллярного метастазирования у пациенток с ранними стадиями РМЖ напрямую зависит не только от размера опухоли, но и от возраста пациентки и наличия лимфоваскулярной инвазии. Так, J. McGee и соавт. показали, что регионарная лимфодиссекция у 6308 больных с микрокарциномами менее 5 мм (T1a) с клинически негативными лимфатическими узлами позволила выявить аксиллярные метастазы в 12% случаев [12]. У больных с размером опухоли T1b (6–10 мм) отмечено увеличение риска регионарного метастазирования на 5–10% [10]. По мнению D. Rivadeneira и соавт., частота поражения аксиллярных лимфатических узлов при размерах опухоли до 1,0 см составляет 18% (16% – при размерах T1a и 18,5% – при размерах карциномы T1b); авторы отмечают, что степень анаплазии G3 увеличивает риск регионарного поражения в 2,6 раза, а наличие лимфоваскулярной инвазии – в 5,5 раза; p
Рис. 1. Метастатические изменения регионарных лимфатических узлов в В-режиме: а – измененный надключичный лимфатический узел неправильной формы; б – измененный округлый подмышечный лимфатический узел.
Fig. 1. B-mode ultrasound images of regional lymph node metastases: a – abnormal supraclavicular lymph node with an irregular shape; b – abnormal round axillary lymph node.
Рис. 2. Метастатические изменения подмышечного лимфатического узла в В-режиме: отмечается неравномерное утолщение коркового слоя с выбуханием контура на отдельном участке.
Fig. 2. B-mode ultrasound image of metastatic axillary lymph node: diffuse thickening of the cortex and cortical bulging of a separate part.
Рис. 3. В-режим: метастатические изменения подмышечного лимфатического узла с кальцинатами в структуре.
Fig. 3. B-mode: metastatic axillary lymph node calcification.
При цветовом и энергетическом допплеровском картировании кровоток в метастатически измененных лимфатических узлах визуализируется в 93% наблюдений. При этом выявляются извитые, разнокалиберные, ветвистые, хаотично расположенные сосуды (рис. 4).
Рис. 4. Энергетическое допплеровское картирование подмышечного лимфатического узла с метастатическими изменениями.
Fig. 4. Color Doppler Energy Mapping of metastatic axillary lymph node.
Интересно, что чувствительность УЗИ в оценке статуса регионарных лимфатических узлов напрямую зависит от биологического подтипа опухоли. Так, по данным R. Helfgott и соавт., чувствительность и специфичность УЗИ в оценке статуса аксиллярных лимфатических узлов составили 39 и 96% соответственно (анализ результатов аксиллярной лимфодиссекции у 583 больных, получивших лечение в 1999–2014 гг.). Минимальный уровень чувствительности УЗИ в оценке статуса лимфатических узлов отмечен для люминального HER2-негативного рака (менее 40%) и максимальная чувствительность показана для тройного негативного и HER2+ подтипов заболевания (68,8 и 71,4% соответственно); p=0,003 [22].
В последние годы широкое распространение получил метод ультразвуковой эластографии и эластометрии. Данная методика представляет собой способ дифференциации тканей по их жесткости путем механического воздействия на них и анализа деформаций, получаемых с помощью ультразвуковых диагностических сканеров [23]. Для оценки жесткости лимфатических узлов используется система качественной оценки результатов компрессионной эластографии лимфатических узлов, разработанная и M. Furukawa и соавт. в 2007 г. [24], согласно которой выделяют 4 степени жесткости узлов: 1-й тип (мягкие), 2-й (умеренно мягкие), 3-й (умеренно жесткие) и 4-й (жесткие). Для метастатических лимфатических узлов характерна жесткая и жестко-неоднородная структура, что соответствует 3 и 4-му типам эластографической картины по M. Furukawa, а для гиперплазированных лимфатических узлов – 1 и 2-й тип эластографической картины (рис. 5).
Рис. 5. Компрессионная эластография лимфатических узлов: а – лимфатический узел с метастатическими изменениями; отмечается неоднородная жесткая структура (3-й тип эластографической картины); б – гиперплазированный лимфатический узел (1-й тип эластографической картины).
Fig. 5. Strain elastography of lymph nodes: a – metastatic lymph node with heterogeneous hardness (elastographic pattern 3); b – hyperplastic lymph node (elastographic pattern 1).
Новым перспективным методом оценки статуса регионарных лимфатических узлов является УЗИ с контрастным усилением – КУУЗИ (contrast-enhanced ultrasound – CEUS). При КУУЗИ опухолево измененных лимфатических узлов выявляется неоднородное центростремительное накопление контрастного агента с возможными дефектами перфузии за счет возможных жидкостных и кальцинированных включений. Неоднородный характер накопления контраста в метастатических лимфатических узлах объясняется разнокалиберностью неопластических сосудов и артериовенозных шунтов [25–27] (рис. 6).
Рис. 6. КУУЗИ лимфатического узла с метастазами РМЖ: негомогенное контрастирование за счет дефектов перфузии.
Fig. 6. Contrast-enhanced ultrasound of lymph node metastasis in BC: inhomogeneous enhancement due to perfusion defects.
Однако даже при тщательном мануальном осмотре и качественно выполненном УЗИ недооценка N+ статуса (ложноотрицательный результат) отмечена у 1/3 больных с ранним РМЖ; именно с такой частотой при выполнении биопсии сторожевого лимфатического узла (БСЛУ) выявляются аксиллярные метастазы при клиническом N0-статусе [28]. Именно поэтому идет активный поиск других неинвазивных методов оценки статуса регионарных лимфатических узлов, среди которых активно изучаются магнитно-резонансная томография (МРТ) молочных желез и позитронно-эмиссионная компьютерная томография (ПЭТ-КТ). В 2017 г. представлен большой метаанализ с включением 21 крупного исследования по оценке роли МРТ молочных желез и ПЭТ-КТ в оценке статуса регионарных лимфатических узлов при раннем РМЖ [29]. Авторы показали преимущество метода МРТ молочных желез перед ПЭТ-КТ в оценке регионарного поражения: при равной чувствительности обоих методов (0,93) различия в специфичности существенны: 0,82 – для МРТ и всего 0,64 для ПЭТ-КТ [29].
Весьма перспективной представляется идея о предоперационной неинвазивной диагностике регионарного метастазирования с помощью моноклональной флюоресцентной визуализации. Конъюгат MamAb-680 представляет собой моноклональное антитело, специфичное к маммаглобину А, конъюгированное с флуоресцентным красителем. Маммоглобин А обнаруживается при РМЖ в опухолевых клетках, но не экспрессируется в неизмененных лимфатических узлах, благодаря чему использование MamAb-680 позволяет дифференцировать метастатически измененные регионарные лимфатические узлы. В результате исследований на лабораторных животных показано, что перитуморальное введение MamAb-680 позволяет визуализировать аксиллярные метастазы in vivo путем флуоресцентной визуализации, причем метод показал высокую чувствительность и специфичность при аксиллярном поражении, на основании чего авторы делают вывод о перспективности дальнейшего изучения данной методики при раннем РМЖ [30].
Окончательным шагом оценки статуса регионарных лимфатических узлов на предоперационном этапе является морфологическая верификация опухолевого поражения путем цитологического/гистологического исследования ткани лимфатического узла, полученного при биопсии [17–21]. Наиболее простым методом верификации регионарного поражения остается тонкоигольная пункционная биопсия под ультразвуковой навигацией; метод стал рутинно использоваться в клинической онкологии несколько десятилетий назад, и уже проанализирована его предсказательная ценность. Так, чувствительность тонкоигольной пункционной биопсии составляет около 71–75%, однако специфичность данного метода достигает 100% [31].
Большой интерес представляют результаты оценки статуса аксиллярных лимфатических узлов на основании данных предоперационной core-биопсии; в анализ H. Abe и соавт. включены 144 больных РМЖ; у 100 женщин с подозрительными лимфатическими узлами выполнена core-биопсия данных лимфатических узлов под ультразвуковым контролем, в результате чего метастазы в лимфатических узлах выявлены в 64% случаев. Оставшимся 36 пациенткам с отсутствием опухолевых изменений в биоптате лимфатических узлов выполнено оперативное лечение с БСЛУ, в результате чего метастазы в аксиллярных лимфатических узлах диагностированы еще у 11% женщин. Остальные 44 пациентки с неизмененными по данным УЗИ лимфатическими узлами на предоперационном этапе не подвергались core-биопсии, а были сразу оперированы; при оценке статуса сторожевых лимфатических узлов у данных больных метастазы выявлены в 27% случаев. Таким образом, по данным авторов, клиническая и ультразвуковая оценка статуса регионарных лимфатических узлов не позволяет выявить до 27% аксиллярных метастазов; core-биопсия подозрительных лимфатических узлов позволяет существенно повысить уровень дифференциальной диагностики и сократить число пациенток с недооцененным N+ статусом до 11% [32].
Хирургическое стадирование и эволюция регионарного лечения при раннем РМЖ
Биопсия сторожевого («сигнального») лимфатического узла является в настоящее время «золотым стандартом» регионарного лечения у больных с ранними стадиями РМЖ [18–21]. Однако еще 30 лет назад было трудно представить отказ от регионарной лимфодиссекции при РМЖ, а выбор такой лечебной тактики при метастазах в аксиллярных лимфатических узлах представлялся и вовсе невозможным; однако серия крупных рандомизированных исследований убедительно доказала онкологическую безопасность подобного подхода [33].
В исследовании NSABP B-32 (NCT00003830) доказана безопасность отказа от регионарной лимфодиссекции при клинически негативных лимфатических узлах, отсутствие метастатического поражения которых подтверждено на операционном этапе при выполнении БСЛУ [34]. В исследование включены в США и Канаде 5611 больных РМЖ I–II стадии без клинико-рентгенологических признаков поражения регионарных лимфатических узлов. Пациенткам 1-й группы (n=2807) выполнялась БСЛУ с аксиллярной лимфодиссекцией вне зависимости от статуса сигнального лимфатического узла, 2-й группы (n=2804) – БСЛУ, и только в случае обнаружения метастаза в сигнальном лимфатическом узле выполнялась аксиллярная лимфодиссекция. Стоит отметить, что частота совпадений дооперационной клинико-рентгенологической диагностики и патоморфологической оценки N-статуса составляла 71,5% случаев в 1-й группе и 71,7% случаев – во 2-й; у данных пациенток отсутствие поражения аксиллярных лимфатических узлов подтверждено плановым морфологическим исследованием. Интересно отметить, что в обеих группах около 28% пациенток с N0-статусом на дооперационном этапе имели метастазы в аксиллярных лимфатических узлах по результатам БСЛУ и последующей регионарной лимфодиссекции. Таким образом, по данным исследования NSABP B-32 ошибка оценки статуса регионарных лимфатических узлов на основании клинико-рентгенологических данных составила около 28%. В дальнейший анализ показателей выживаемости включены пациентки с морфологически доказанным N0-статусом (n=3989); при медиане наблюдения 95,6 мес показатели выживаемости были идентичными у пациенток, перенесших регионарную лимфодиссекцию и только БСЛУ. Так, ОВ 91,8% vs 90,3%; р=0,54; БРВ – 82,4% vs 81,5%; р=0,22. Число регионарных рецидивов было крайне низким (всего 8 случаев в группе лимфодиссекции и 14 случаев – в группе БСЛУ). Полученные результаты исследования доказали безопасность выполнения БСЛУ у больных с клинически негативным статусом лимфатических узлов и легли в основу международных рекомендаций по регионарному лечению раннего РМЖ [34].
Следующим шагом в эволюции регионарного лечения стала оценка возможности отказа от стандартной аксиллярной лимфодиссекции у пациенток с наличием метастазов в 2 сигнальных лимфатических узлах и менее. В рандомизированное исследование III фазы American College of Surgeons Oncology Group Z0011 (ACOSOG Z0011) были включены 856 больных РМЖ с размерами опухоли T1-2, перенесших органосохраняющие операции с БСЛУ, при которых выявлены метастазы в 2 сигнальных лимфатических узлах и менее. Пациентки были рандомизированы на группу только БСЛУ (объем регионарного лечения не менялся после обнаружения метастазов в сигнальных лимфатических узлах, n=446) и группу БСЛУ с последующей регионарной лимфодиссекцией (n=445). Следует отметить, что после выполнения лимфодиссекции выявлены макрометастазы (более 2 мм) в несигнальных лимфатических узлах еще у 27,3% больных 2-й группы, что подтверждает данные предшествующих исследований по несовершенству дооперационной оценки регионарного статуса лимфатических узлов при раннем РМЖ. После операции пациентки получали лечение в соответствии с биологическими характеристиками опухоли (адъювантная системная терапия проведена у 97% пациенток, адъювантная лучевая терапия – у 89%). При медиане наблюдения 9,3 года показатели 10-летней выживаемости были весьма схожими у пациенток из группы только БСЛУ и пациенток, перенесших БСЛУ и лимфодиссекцию (ОВ – 86,3% vs 83,6%; р=0,72; БРВ – 80,2% vs 78,2%; р=0,51). Результаты длительного наблюдения за больными показали крайне низкий уровень регионарных рецидивов (0,5% – в группе аксиллярной лимфодиссекции и 1,5% в группе БСЛУ; р=0,28), 10-летняя частота локорегионарного рецидивирования была также низка и сопоставима: 6,2% vs 5,3%; p=0,36 [35, 36]. Результаты исследования ACOSOG Z0011 послужили основанием для изменения рекомендаций европейских и американских онкологических сообществ, которые включили возможность отказа от лимфодиссекции у пациенток с T1-2-размерами опухоли, при обнаружении метастазов в 2 сигнальных лимфатических узлах и менее, при условии выполнения органосохраняющего лечения и последующей лучевой терапии [18–21].
Успехи в лекарственной терапии раннего РМЖ и совершенствование методик лучевой терапии привели к идее отказа от аксиллярной лимфодиссекции в пользу лучевой терапии на зоны лимфооттока у больных с любым числом пораженных сигнальных лимфатических узлов. В 2001–2010 гг. проведено многоцентровое рандомизированное исследование EORTC 10981-22023 AMAROS с включением 4823 больных РМЖ из 34 стран Европы [37]. Все пациентки имели T1-2 размер опухоли, клинически негативный статус лимфатических узлов на дооперационном этапе, однако при выполнении БСЛУ 1425 больных имели макро- или микрометастазы в сигнальных лимфатических узлах. В соответствии с дизайном исследования пациентки с пораженными аксиллярными лимфатическими узлами рандомизированы в соотношении 1:1 в группу аксиллярной лимфодиссекции или группу аксиллярной лучевой терапии. В соответствии с объемом хирургического лечения пациенткам в обеих группах выполнялась лучевая терапия на оставшуюся часть молочной железы ± парастернальную зону. Следует отметить, что в группе лимфодиссекции у 33% больных выявлены метастазы в дополнительно удаленных несигнальных лимфатических узлах (в 25% случаев – до 3 дополнительных пораженных лимфатических узлов, в 8% случаев – в 4 лимфатических узлах и более). При медиане наблюдения 6,1 года доля регионарных рецидивов была крайне низка в обеих группах (0,43% – в группе аксиллярной лимфодиссекции и 1,19% – в группе лучевой терапии на аксиллярную зону), а показатели 5-летней выживаемости высоки и идентичны: 5-летняя БРВ – 86,9% vs 82,7%; р=0,18; 5-летняя ОВ – 93,3% vs 92,5%; р=0,34). На основании результатов исследования EORTC 10981-22023 AMAROS авторы делают вывод, что оба метода регионарного лечения при поражении аксиллярных лимфатических узлов правомочны – аксиллярная лимфодиссекция или лучевая терапия на зону аксиллярных лимфатических узлов. Однако отказ от лимфодиссекции в пользу лучевой терапии на аксиллярную зону лимфооттока имеет преимущества в отношении функциональных результатов и качества жизни пациенток с ранним РМЖ [37].
Заключение
Анализ мировой литературы показал, что риск поражения аксиллярных лимфатических узлов при раннем РМЖ напрямую зависит от размера первичной карциномы и ее биологических характеристик [38, 39]. Клинический осмотр и современное УЗИ являются наиболее доступными методами оценки статуса регионарных лимфатических узлов, но вероятность недооценки их метастатического поражения имеют около 1/4 больных. Верификация диагноза на предоперационном этапе (core-биопсия лимфатических узлов под ультразвуковой навигацией) позволяет минимизировать число ошибок регионарного стадирования до 11%. Современное лекарственное лечение, основанное на биологических характеристиках опухоли, изменило прогноз заболевания при раннем РМЖ, что позволяет пересмотреть наши взгляды на объем регионарного лечения не только у больных с негативными аксиллярными лимфатическими узлами, но и у пациенток с наличием метастатического поражения [40]. Качественное регионарное стадирование, выбор лечебного алгоритма в соответствии с биологическими характеристиками карциномы, проведение максимально эффективных современных лекарственных режимов, оптимальной лучевой терапии позволяют не только минимизировать объем хирургического лечения, но и достичь высоких отдаленных результатов выживаемости, обеспечить отличные функциональные результаты и высокое качество жизни у пациенток с пораженными аксиллярными лимфатическими узлами.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.